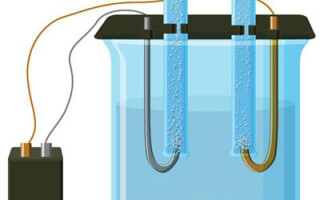
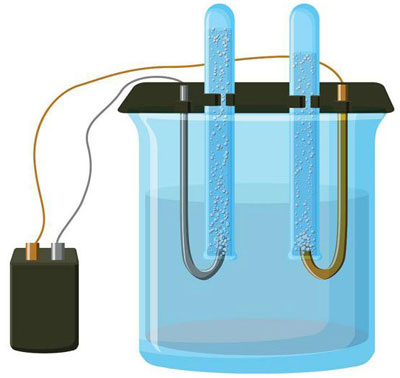
Die Frage, was Elektrolyse ist, wird seit dem Physikunterricht in der Schule diskutiert und ist für die meisten Menschen kein Geheimnis. Ein weiterer Punkt ist die Bedeutung und die praktische Anwendung. Dieses Verfahren wird in verschiedenen Branchen mit großem Vorteil eingesetzt und kann auch für den Heimwerker nützlich sein.
Inhalt
- 1 Was ist Elektrolyse?
- 2 Faradaysche Gesetze der Elektrolyse
- 3 Elektrolyse von Schmelzen
- 4 Merkmale der Elektrolyse in Lösungen
- 5 Elektrolyse in Gasen
- 6 Merkmale der an der Kathode und der Anode ablaufenden Prozesse
- 7 Faktoren, die den Elektrolyseprozess beeinflussen
- 8 Wo wird die Elektrolyse angewendet?
- 9 Energiekosten
Was ist Elektrolyse?
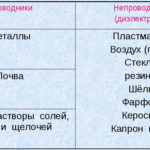
Die Elektrolyse ist ein Komplex spezifischer Prozesse in einem Elektroden- und Elektrolytsystem, das von einem konstanten elektrischen Strom durchflossen wird. Der Mechanismus beruht auf der Erzeugung eines Ionenstroms. Der Elektrolyt ist ein Typ-2-Leiter (ionische Leitfähigkeit), in dem eine elektrolytische Dissoziation stattfindet. Dies beinhaltet die Zersetzung in Ionen mit positivem (kation) und negativ (Anion) aufladen.
Ein Elektrolysesystem enthält notwendigerweise einen positiven (Anode) und eine negative (Kathode) Elektrode. Wenn ein elektrischer Gleichstrom angelegt wird, bewegen sich die Kationen zur Kathode und die Anionen zur Anode. Bei den Kationen handelt es sich hauptsächlich um Metallionen und Wasserstoff, bei den Anionen um Sauerstoff und Chlor. An der Kathode gewinnen die Kationen überschüssige Elektronen und ermöglichen so die Reduktionsreaktion Men+ + ne → Me (wobei n die Wertigkeit des Metalls ist). An der Anode hingegen werden Elektronen vom Anion zurückgegeben, und es findet eine Oxidationsreaktion statt.
Auf diese Weise wird der Redoxprozess im System sichergestellt. Wichtig ist jedoch, dass der Prozess Energie erfordert. Diese muss von einer externen Stromquelle bereitgestellt werden.
Faradaysche Gesetze der Elektrolyse
Der große Physiker M. Faraday ermöglichte es mit seinen Forschungen nicht nur, das Wesen der Elektrolyse zu verstehen, sondern auch die notwendigen Berechnungen für ihre Anwendung anzustellen. Im Jahr 1832 erschienen seine Gesetze, die die wichtigsten Parameter der ablaufenden Prozesse miteinander verknüpften.
Das erste Gesetz
Das erste Faraday'sche Gesetz besagt, dass die Masse einer an der Anode reduzierten Substanz direkt proportional zu der im Elektrolyten induzierten elektrischen Ladung ist: m = kq = k*I*t, wobei q die Ladung, k der Koeffizient oder das elektrochemische Äquivalent der Substanz, I der durch den Elektrolyten fließende Strom und t die Zeit des Stromflusses ist.

Zweites Gesetz
Das zweite Faradaysche Gesetz ermöglichte die Bestimmung des Proportionalitätskoeffizienten k. Sie lautet: Das elektrochemische Äquivalent eines Stoffes ist direkt proportional zu seiner molaren Masse und umgekehrt proportional zu seiner Wertigkeit. Das Gesetz wird in der Form ausgedrückt:

k = 1/F*A/zwobei F die Faraday-Konstante, A die molare Masse des Stoffes und z seine chemische Wertigkeit ist.
Unter Berücksichtigung beider Gesetze lässt sich die endgültige Formel zur Berechnung der Masse der auf der Elektrode abgelagerten Substanz ableiten: m = A*I*t/(n*F)wobei n die Anzahl der an der Elektrolyse beteiligten Elektronen ist. In der Regel entspricht n der Ladung des Ions. Aus praktischer Sicht ist es wichtig, die Masse der Substanz mit der angelegten Stromstärke in Beziehung zu setzen, um den Prozess durch Variation der Stromstärke steuern zu können.
Elektrolyse von Schmelzen
Eine Variante der Elektrolyse besteht darin, eine Schmelze als Elektrolyt zu verwenden. In diesem Fall sind nur die Ionen der Schmelze am elektrolytischen Prozess beteiligt. Ein klassisches Beispiel ist die Elektrolyse der Salzschmelze NaCl (Speisesalz). Negative Ionen strömen zur Anode, was bedeutet, dass Gas freigesetzt wird (Cl). An der Kathode kommt es zu einer Reduktion des Metalls, d. h. zur Abscheidung von reinem Na, das sich aus den positiven Ionen bildet, die überschüssige Elektronen angezogen haben. Andere Metalle können auf ähnliche Weise hergestellt werden (K, Ca, Li usw.) aus der Auflösung der jeweiligen Salze.
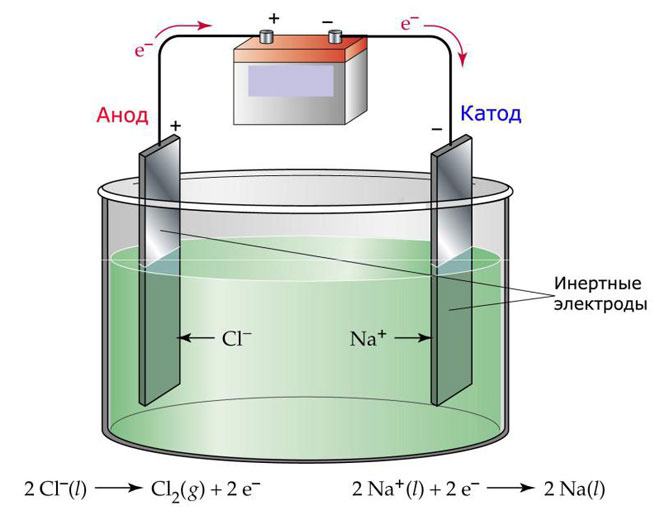
Bei der Schmelzflusselektrolyse werden die Elektroden nicht aufgelöst, sondern dienen nur als Stromquelle. Zu ihrer Herstellung können Metall, Graphit und einige Halbleiter verwendet werden. Es ist wichtig, dass das Material eine ausreichende Leitfähigkeit aufweist. Eines der am häufigsten verwendeten Materialien ist Kupfer.
Merkmale der Elektrolyse in Lösungen
Die Elektrolyse in einer wässrigen Lösung unterscheidet sich deutlich von der Schmelzflusselektrolyse. Hier gibt es 3 konkurrierende Prozesse: die Oxidation von Wasser unter Abgabe von Sauerstoff, die Oxidation des Anions und die anodische Auflösung des Metalls. An dem Prozess sind Wasserionen, der Elektrolyt und die Anode beteiligt. Dementsprechend kann die Reduktion von Wasserstoff, Elektrolytkationen und Anodenmetall an der Kathode stattfinden.

Ob diese konkurrierenden Prozesse ablaufen können, hängt vom elektrischen Potenzial des Systems ab. Es wird nur der Prozess stattfinden, der weniger externe Energie benötigt. Daher werden die Kationen mit dem höchsten Elektrodenpotential an der Kathode reduziert, und die Anionen mit dem niedrigsten Potential werden an der Anode oxidiert. Das Elektrodenpotential von Wasserstoff wird als "0" angenommen. In Kalium ist es zum Beispiel gleich (-2,93 В), Natrium ist (-2,71 В), Blei (-0,13 В), und für Silber ist es (+0,8 В).
Elektrolyse in Gasen
Das Gas kann nur dann als Elektrolyt wirken, wenn ein Ionisator vorhanden ist. In diesem Fall fließt ein Strom durch das ionisierte Medium, der an den Elektroden den erforderlichen Prozess auslöst. Die Faradayschen Gesetze gelten nicht für die Gaselektrolyse. Solche Bedingungen sind für seine Verwirklichung notwendig:
- Weder Hochspannung noch Hochstrom können ohne künstliche Ionisierung des Gases helfen.
- Nur sauerstofffreie gasförmige Säuren und bestimmte Gase sind für die Elektrolyse geeignet.
Wichtig! Das Verfahren funktioniert ähnlich wie die Elektrolyse in einem flüssigen Elektrolyten, wenn die erforderlichen Bedingungen erfüllt sind.
Merkmale der an der Kathode und der Anode ablaufenden Prozesse
Für die praktische Anwendung der Elektrolyse ist es wichtig zu verstehen, was an beiden Elektroden passiert, wenn ein elektrischer Strom angelegt wird. Die folgenden Prozesse sind charakteristisch:
- Kathode. Die positiv geladenen Ionen stürmen auf sie zu. Hier findet die Reduktion von Metallen oder die Freisetzung von Wasserstoff statt. Es lassen sich mehrere Kategorien von Metallen nach ihrer kationischen Aktivität unterscheiden. Metalle wie Li, K, Ba, St, Ca, Na, Mg, Be, Al werden nur aus geschmolzenen Salzen gut reduziert. Wird eine Lösung verwendet, so wird durch Elektrolyse von Wasser Wasserstoff freigesetzt. Die folgenden Metalle können in Lösung zurückgewonnen werden, allerdings nur bei einer ausreichenden Konzentration von Kationen: Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Das Verfahren ist am einfachsten für Ag, Cu, Bi, Pt, Au und Hg.
- Anode. Negativ geladene Ionen werden dieser Elektrode zugeführt. Bei der Oxidation nehmen sie dem Metall Elektronen ab, was zu ihrer anodischen Auflösung führt, d. h. Die Anionen werden in positiv geladene Ionen umgewandelt, die zur Kathode geleitet werden. Auch die Anionen werden nach ihrer Aktivität unterteilt. Nur die Anionen PO4, CO3, SO4, NO3, NO2, ClO4, F können aus den Schmelzen ausgeschieden werden. In wässrigen Lösungen werden sie nicht der Elektrolyse unterworfen, sondern dem Wasser unter Freisetzung von Sauerstoff. Anionen wie OH, Cl, I, S und Br sind die am leichtesten reagierenden.

Bei der Elektrolyse ist es wichtig, die Oxidationsneigung des Elektrodenmaterials zu berücksichtigen. Es wird zwischen inerten und aktiven Anoden unterschieden. Inerte Elektroden werden aus Graphit, Kohlenstoff oder Platin hergestellt und sind nicht an der Ionenversorgung beteiligt.
Faktoren, die den Elektrolyseprozess beeinflussen
Der Elektrolyseprozess hängt von folgenden Faktoren ab
- Die Zusammensetzung des Elektrolyten. Die verschiedenen Verunreinigungen üben einen erheblichen Einfluss aus. Diese werden in 3 Arten unterteilt - Kationen, Anionen und organische Stoffe. Die Substanzen können mehr oder weniger negativ als das unedle Metall sein, was den Prozess beeinträchtigt. Zu den organischen Verunreinigungen gehören Schadstoffe (z. B. Öle) und Tenside. Ihre Konzentrationen liegen im Bereich der zulässigen Höchstwerte.
- Stromdichte. Nach dem Faraday'schen Gesetz nimmt die Masse der abgelagerten Substanz mit der Stärke des Stroms zu. Es treten jedoch ungünstige Umstände auf - konzentrierte Polarisierung, erhöhte Spannung, starke Erwärmung des Elektrolyten. In diesem Sinne gibt es optimale Werte für die Stromdichte in jedem Fall.
- Elektrolyt-pH. Auch der Säuregehalt des Mediums wird unter Berücksichtigung der Metalle ausgewählt. Der optimale pH-Wert für Zink liegt zum Beispiel bei 140 g/cm3.
- Temperatur des Elektrolyten. Dies hat eine zweideutige Wirkung. Mit steigender Temperatur erhöht sich die Elektrolysegeschwindigkeit, aber auch die Aktivität der Verunreinigungen. Für jedes Verfahren gibt es eine optimale Temperatur. Sie liegt normalerweise zwischen 38 und 45 Grad.
Wichtig! Die Elektrolyse kann durch verschiedene Einflüsse und die Wahl der Elektrolytzusammensetzung beschleunigt oder verlangsamt werden. Für jede Anwendung gibt es eine andere Regelung, die strikt eingehalten werden muss.
Wo wird die Elektrolyse eingesetzt?
Die Elektrolyse wird in vielen Bereichen eingesetzt. Es gibt mehrere Hauptverwendungszwecke, die für praktische Ergebnisse unterschieden werden können.
Galvanik
Dünne, widerstandsfähige galvanische Metallbeschichtungen können durch Elektrolyse aufgebracht werden. Der beschichtete Gegenstand wird als Kathode in ein Bad gelegt und der Elektrolyt enthält ein Salz des gewünschten Metalls. So kann man Stahl mit Zink, Chrom oder Zinn beschichten.

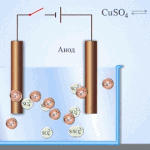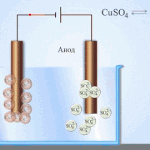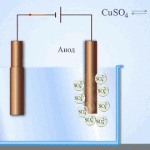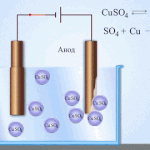
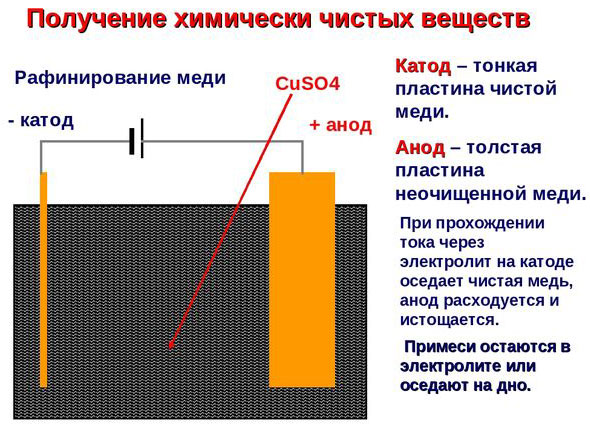
Elektroraffination - Raffination von Kupfer
Ein Beispiel für ein Elektrobehandlungsverfahren wäre Kathode - reines Kupfer Anode - Kupfer mit Verunreinigungen, Elektrolyt - wässriger Kupfersulfatlösung. Das Kupfer der Anode wandelt sich in Ionen um und wird ohne Verunreinigungen an der Kathode abgeschieden.
Metallgewinnung
Um Metalle aus Salzen zu extrahieren, werden die Metalle geschmolzen und dann in der Schmelze elektrolysiert. Dieses Verfahren ist sehr effektiv bei der Gewinnung von Aluminium aus Bauxit, Natrium und Kalium.

Eloxieren
Bei diesem Verfahren wird die Beschichtung aus nicht-metallischen Verbindungen hergestellt. Das klassische Beispiel ist die Eloxierung von Aluminium. Das Aluminiumteil ist wie eine Anode montiert. Der Elektrolyt ist eine Lösung von Schwefelsäure. Durch die Elektrolyse wird auf der Anode eine Aluminiumoxidschicht abgeschieden, die schützende und dekorative Eigenschaften hat. Die oben genannten Technologien sind in verschiedenen Branchen weit verbreitet. Es ist auch möglich, die Verfahren mit den eigenen Händen und auf sichere Weise auszuführen.
Energiekosten
Die Elektrolyse erfordert einen hohen Energieaufwand. Das Verfahren ist von praktischem Wert, wenn der anodische Strom ausreichend ist, was die Zufuhr eines erheblichen Gleichstroms aus der Stromquelle erfordert. Darüber hinaus entstehen seitliche Spannungsverluste - anodische und kathodische Überspannungen - sowie Verluste im Elektrolyten aufgrund seines Widerstands. Der Wirkungsgrad einer Anlage wird bestimmt, indem die Leistung der zugeführten Energie auf die Einheit der Nutzmasse des gewonnenen Stoffes bezogen wird.
Die Elektrolyse wird in der Industrie seit langem mit hoher Effizienz eingesetzt. Eloxieren und Galvanisieren sind aus dem Alltag nicht mehr wegzudenken, und die Materialgewinnung und -verarbeitung hilft bei der Gewinnung vieler Metalle aus Erzen. Der Prozess kann geplant und berechnet werden, wenn man seine Grundmuster kennt.
Ähnliche Artikel: