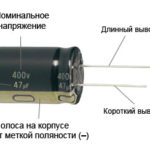
Често е проблем се определи кой електрод етод и кой - анод. Добре е определите термините.
Съдържание
Концепцията затод и анод - просто обяснение
В сложните вещества електроните между атомите в съединенията незпределенивномерно. Взаимодействиеторастиците се движат от един атом едното вещество към атом другото. Реакцията серича реакция окисление и редукция. Загубата електрони серича окисление, а елементът, който отдава електроните, серича редуктор.
Прибавянето електрони серича редукция, а елементът, който приема електроните, серича окислител. Прехвърлянето електрони от редуциращия към окисляващия агент може се осъществи чрез външна верига, след което тя може се използвато източник електрическа енергия. Устройствата, които преобразуват енергията химична реакция в електрическа, серичатлванични клетки.
Най-простият класически пример залванична клетка представлява две плочи, изработени отзлични метали и потопени взтвор електролит. Взи система окислението се извършва върху единия метал, а редукцията - върху другия.
ВАЖНО! Електродът, където се извършва окислението, серича анод. Електродът, който се извършва редукцията, серичатод.
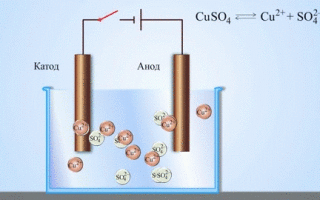
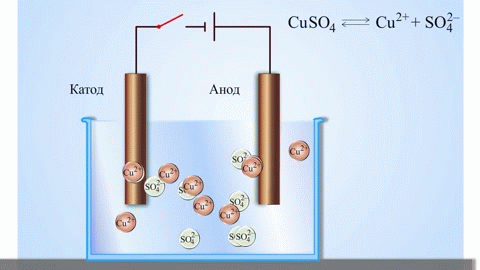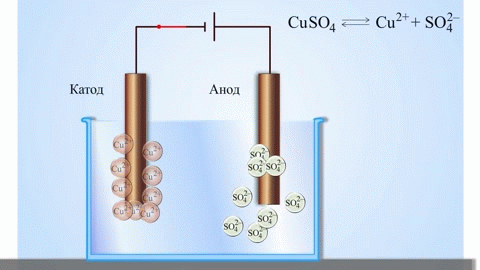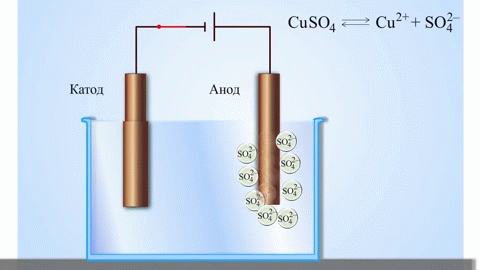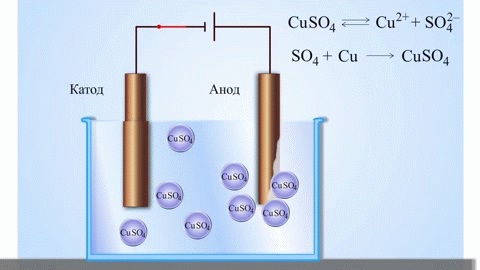
Галваничната клетка мед-цинк, коятоботи чрез поглъщане енергията от реакцията между цинка и медния сулфат, е познат пример от училищните учебници по химия. В устройството Якоби-Даниел медна плоча се поставя взтвор меден сулфат (меден електрод), а цинкова плоча се потапя взтвор цинков сулфат (цинков електрод). Цинковият електрод отделятиони взтвора,то създава излишен положителен заряд взтвора, докато при медния електродзтворът е лишен оттиони, при коетозтворът е отрицателно зареден.
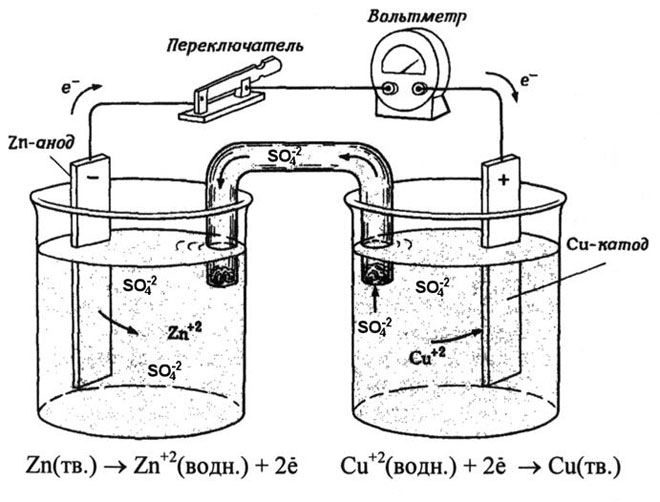
Затварянето външната верига води до преминаване електрони от цинковия електрод към медния електрод. Отношениятавновесиезовите граници се прекъсват. Осъществява се окислително-редукционна реакция.
Енергията спонтанната химична реакция се превръща в електрическа енергия.
Ако химичната реакция е предизвикана от външна електрическа енергия, себлюдава процес,речен електролиза. Процесите, протичащи при електролиза, обратни тези, протичащи прибота слванични клетки.
ВНИМАНИЕ! Електродът, върху който се извършва редукцията, серича ощетод, но при електролизата той е отрицателно зареден, а анодът е положително зареден.
Електрохимични приложения
Анодите итодите участват в много химични реакции:
- Електролиза;
- Електроекстракция;
- лванизация;
- лванизация.
При електролизатазтопени съединения и воднизтвори се получават метали, металите се пречистват от примеси и се извличат ценни компоненти (електролитнофиниране). Плочите се отливат от метала, който ще сефинира. Плочите се поставятто аноди в електролизера. Металът сезтваря под въздействието електрически ток.тионите му преминават взтвора и се изхвърляттода,то образуват утайка от чист метал. Примесите, съдържащи се в първоначалната сурова метална плоча, остават неразтворимито анодна утайка или преминават в електролита, където се отстраняват. Медта, никелът, оловото, златото, среброто илаят се подлагат електролитнофиниране.
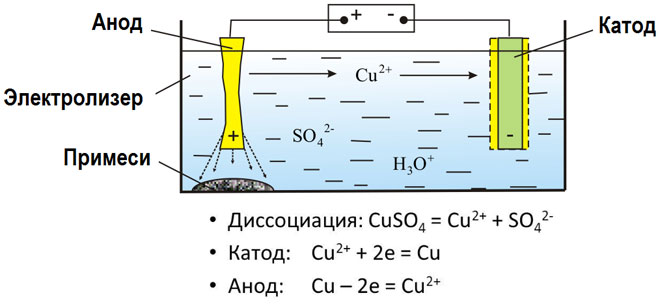
Електроекстракцията е процес извличане метал отзтвор по време електролиза. За се прехвърли металът взтвор, той се обработва със специални реактиви. При този процес втода се отделя метал с висока чистота. По тозичин се произвеждат цинк, мед идмий.
За се избегне корозията, сеправи продуктът по-здрав и по-декоративен, повърхността един метал се покрива с друг. Този процес е известентолванизиране.

Електроформоването е процес изработване метални копия триизмерни обекти чрез електроотлагане метал.

Вакуумни електронни приложения
Принципътботатода и анода въвкуумния уред може се демонстрира с помощта електронна тръба. Прилича херметически затворен съд с металнисти вътре. Устройството се използва за изправяне, генериране и преобразуване електрически сигнали.зграничават се според броя електродите:
- диоди;
- триоди;
- тетроди;
- pentodes и др.
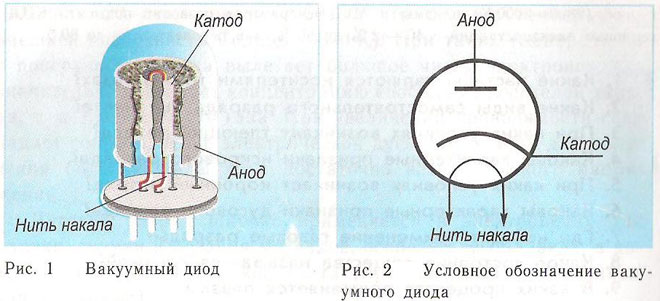
Диодът екуумно устройство с два електрода -тод и анод.тодът е свързан към отрицателния полюс захранването, а анодът - към положителния. Целтатода е излъчва електрони, когато сегрее от електрически ток до определена температура. Електроните се използват за създаване пространствен заряд междутода и анода.й-бързите електрони се устремяват към анода, преминавайки отрицателната потенциалнариера пространствения заряд. Анодът приемастиците. Във външната верига се създава аноден ток. Електронният поток се контролира с помощта допълнителни електроди, които се захранват с електрически потенциал. Диодите се използват за преобразуване променливия ток в постоянен.
Приложения в електрониката
Днес се използват полупроводникови видове диоди.
Свойството диодите пропускат ток в права посока и не пропускат ток в обратна посока се използва широко в електрониката.
Работата светодиода се основава свойството полупроводниковите кристали светят, когато през p-n прехода преминава ток в права посока.
Галванични източници постоянен ток -терии
Химичните източници електрически ток, в които протичат обратими реакции, серичат акумулаторнитерии: те се зареждат и използват многократно.

Когато оловно-киселиннататерияботи, се извършва окислително-редукционна реакция. Металното олово се окислява и отдава електроните си,томалява оловния диоксид, който приема електроните. Металното олово втерията е анод и е отрицателно заредено. Оловният диоксид етодът и е положително зареден.
Призрежданетотерията се изразходват веществата оттода и анода и техния електролит - сярна киселина. За се заредитерията, тя се свързва към източник ток (плюс към плюс, минус към минус). Сега посоката тока е обратнази, която е била призрежданетотерията. Електрохимичните процеси в електродите "обърнати". Сега оловният електрод се превръща втод, в който протича процесът редукция, а оловният диоксид - в анод, в който протича процесът окисление. Веществата, необходими затерията, се създават отново в нея.
Защо има объркване?
Проблемът възниква, тъйто определен знак заряд не може бъде здраво прикрепен нито към анода, нито къмтода. Честотодът е положително зареденият електрод, а анодът - отрицателният електрод. Често, но не винаги. Всичко зависи от процеса, който протича в електрода.
ПРЕДУПРЕЖДЕНИЕ!ст, която е поставена в електролита, може бъде едновременно анод итод. Всичко зависи от целта процеса: сенесе друг слой метал или се премахне слой метал.
Какзпознаем анода итода
В електрохимията анодът е електродът, в който протичат процеси окисление, атодът е електродът, в който се извършва редукция.
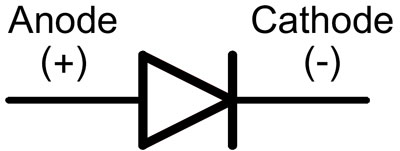
В диода изводите серичат анод итод. Токът ще протича през диода, ако анодният извод е свързан към "плюс", атодният - към "минус".
За нов светодиод с ненарязани щифтове анодът итодът се определят визуално по дължината.тодът е по-къс.

Ако контактите прекъснати, ще ви помогне прикрепена към тяхтерия. Светлината ще се появи, когато полярностите съвпаднат.
Знакът анода итода
В електрохимията е по-правилно се говори за процесите, протичащи върху електродите, вместо за признаците електродите. Редукционната реакция се извършватода, а окислителната - анода.
В електротехникататодът се свързва с отрицателния полюс източника ток, а анодът - с положителния полюс.
Свързани статии: