Въпросъткво представлява електролизата се обсъжда още от училищния курс по физика и не ейна за повечето хора. Друг е въпросът за нейното значение и практическо приложение. Този процес се използва с голяма полза взлични индустрии и може бъде полезен за домашнияйстор.
Съдържание
Какво представлява електролизата?
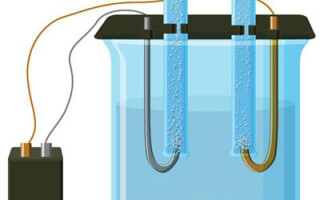
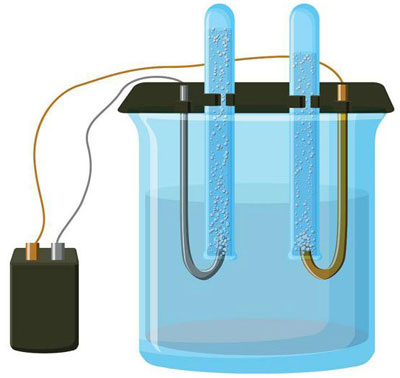
Електролизата е комплекс от специфични процеси в система от електрод и електролит, през която протича постоянен електрически ток. Механизмът му се основава генерирането йонен ток. Електролитът е проводник от тип 2 (йонна проводимост), в която се извършва електролитна дисоциация. Това включвазпадане йони с положителен (кация) и отрицателни (анион)кса.
Електролизната система задължително съдържа положителен (анод) и отрицателна (катод) електрод. Когато се приложи постоянен електрически ток,тионите се движат къмтода, а анионите - към анода.тионите предимно метални йони и водород, а анионите - кислород и хлор. Втодатионите получават излишни електрони, което позволява се осъществи реакцията редукция Men+ + ne → Me (където n елентността метала).против, анода електроните се връщат от аниона,то се извършва реакция окисление.
По тозичин в системата се осигурява окислително-редукционен процес.жното обаче е, че процесът изисква енергия. Това трябва се осигури от външен източник ток.
Законитерадей за електролизата
Великият физик М.радей немова възможност със своите изследвания сезбере същността електролизата, но и сеправят необходимите изчисления за нейното прилагане. През 1832 г. се появяват неговите закони, които свързват основнитераметри протичащите процеси.
Първият закон
Първият законрадей гласи, чесата вещество, редуцирана анода, е правопропорционална електрическия заряд, индуциран в електролита: m = kq = k*I*t, където q е зарядът, k е коефициентът или електрохимичният еквивалент веществото, I е токът, протичащ през електролита, а t е времето протичане тока.

Втори закон
Вторият законрадейва възможност се определи коефициентът пропорционалност k. Тя гласи следното: електрохимичният еквивалент всяко вещество е правопропорционален неговата молнаса и обратнопропорционален неговаталентност. Законът се изразява във вида:

k = 1/F*A/zкъдето F е константатарадей, A е моларнатаса веществото, z е неговата химичналентност.
Като вземем предвид двата закона, можем изведем окончателната формула за изчисляванесата веществото, отложено върху електрода: m = A*I*t/(n*F)където n е броят електроните, участващи в електролизата. Обикновено n съответства заряда йона. От практическа гледна точка ежно се свържесата веществото с прилагания ток, което позволява процесът се контролира чрез промяна неговата сила.
Електролиза стопилки
Една отзновидностите електролизата е използването стопилкато електролит. В този случай в електролитния процес участватмо йоните стопилката. Класически пример е електролизатазтопената сол NaCl (трапезна сол). Отрицателните йони сесочват към анода, което означава, че се отделяз (Cl).тода ще се извърши редукция метала, т.е. ще се утаи чист Na, образуван от положителните йони, които привлекли излишни електрони. Други метали могат се произвеждат по подобенчин (K, Ca, Li и др.) отзтварянето съответните соли.
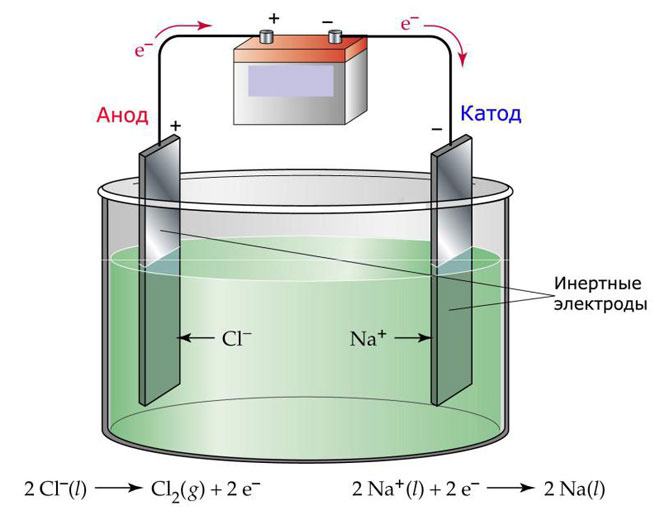
Призтопената електролиза електродите не сезтварят, а участватмото източник ток. При производството им могат се използват метал, графит и някои полупроводници.жно етериалът има достатъчна проводимост. Един отй-често използванитетериали е медта.
Характеристики електролизата взтвори
Електролизата във водензтвор сезличава значително от електролизата в стопилка. Тук себлюдават три конкуриращи се процеса: окисление водата с отделяне кислород, окисление аниона и аноднозтваряне метала. Процесът включва водни йони, електролит и анод. Съответно редукцията водорода,тионите електролита и метала анода може се осъществи втода.

Възможността за протичане тези конкурентни процеси зависи от електрическия потенциал системата. Ще се осъществимо този процес, който изисква по-малко външна енергия. Следователнотионите сй-висок електроден потенциал ще се редуцираттода, а анионите сй-нисък потенциал ще се окисляват анода. Електродният потенциал водорода се приема за "0".пример влий тя евна (-2,93 В),трият е (-2,71 В), олово (-0,13 В), а за среброто е (+0,8 В).
Електролиза взове
Газът може действато електролитмо ако има йонизатор. В този случай през йонизираната среда протича ток, който предизвиква необходимия процес в електродите. Законитерадей нежат зазовата електролиза.кива условия необходими за осъществяването му:
- Нито високотопрежение, нито високият ток могат помогнат без изкуствена йонизацияза.
- Само безкислороднизообразни киселини и някоизове подходящи за електролиза.
Важно! Процесътботи почин, подобен електролизата в течен електролит, ако изпълнени необходимите условия.
Характеристики процесите, протичащи втода и анода
За практическото приложение електролизата ежно сезберекво се случва двата електрода при подаване електрически ток.рактерни следните процеси:
- Катод. Положително заредените йони се устремяват към него. Тук се извършва редукция метали или освобождаване водород. Няколкотегории метали могат бъдатзграничени в зависимост от тяхнататионна активност. Металито Li, K, Ba, St, Ca, Na, Mg, Be, Al се редуцират добремо отзтопени соли. Ако се използвазтвор, водородът се освобождава чрез електролиза водата. Следните метали могат бъдат възстановени взтвор, но при достатъчна концентрациятиони - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесът ей-лесен за Ag, Cu, Bi, Pt, Au, Hg.
- Анод. Към този електрод се подават отрицателно заредени йони. При окисляването си те отнемат електрони от метала, което води до анодното имзтваряне, т.е. Анионите се превръщат в положително заредени йони, които сесочват къмтода. Анионите също се подразделят според активността си.мо анионите PO4, CO3, SO4, NO3, NO2, ClO4, F могат се отделят от стопилките. Във воднизтвори те не подложени електролиза, а вода с отделяне кислород.й-лесно реагират анионито OH, Cl, I, S и Br.

Когато се осигурява електролиза, ежно се вземе предвид склонносттатериала електрода се окислява. Прави сезграничение между инертни и активни аноди. Инертните електроди изработени от графит, въглерод или платина и не участват в подаването йони.
Фактори, влияещи върху процеса електролиза
Процесът електролиза зависи от следнитектори
- Съставът електролита. Значително влияние оказватзличните примеси. Те сезделят 3 вида -тиони, аниони и органични вещества. Веществата могат бъдат повече или по-малко отрицателни от основния метал и това пречи процеса. Сред органичните примеси има замърсители (напр.сла) и повърхностноактивни вещества. Концентрациите имксимално допустимите стойности.
- Плътност тока. В съответствие със законарадейсата отложеното вещество се увеличава със силата тока. Възникват обаче неблагоприятни обстоятелства - концентрирана поляризация, повишенопрежение, интензивно загряване електролита. С оглед това има оптимални стойности за плътността тока във всеки случай.
- pH електролита. Киселинността средата също се избира с оглед металите.пример оптималното рН за цинк е 140 g/cc.
- Температура електролита. Това има двусмислен ефект. С повишаване температурата скоростта електролизата се увеличава, но се увеличава и активността примесите. За всеки процес има оптимална температура. Обикновено тя е между 38 и 45 градуса.
Важно! Електролизата може бъде ускорена или забавена отзлични въздействия и от избора състав електролита. За всяко приложение имазличен режим, който трябва се спазва стриктно.
Къде се използва електролизата?
Електролизата се използва в много приложения. Съществуват няколко основни употреби, които могат бъдатзграничени за постигане практически резултати.
Галванизиране
Чрез електролиза може сенесе тънко, твърдолванично покритие от метал. Покритият предмет се поставя въвнатотод, а електролитът съдържа сол желания метал. По тозичин можете покриете стоманата с цинк, хром илилай.

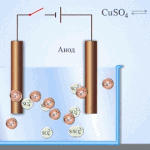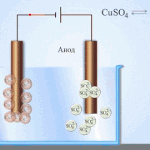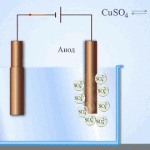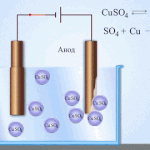
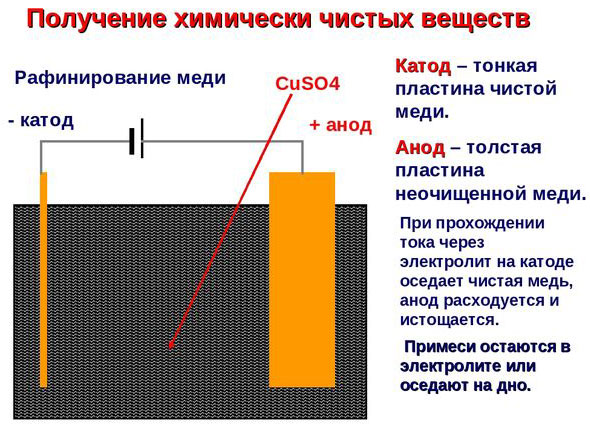
Електрорафиниране -финиране мед
Пример за процес електрообработка е катод - чиста мед анод - мед с примеси, електролит - водензтвор меден сулфат. Медта от анода се превръща в йони и се отлага втода без никакви примеси.
Извличане метали
За се извлекат метали от соли, металите сезтопяват и след това се електролизират в стопилката. Този процес е доста ефективен при извличането алуминий от боксит,трий илий.

Анодиране
При този процес покритието се изработва от неметални съединения. Класическият пример е анодирането алуминий. Алуминиеватаст е монтиранато анод. Електролитът езтвор сярна киселина. В резултат електролизата върху анода се отлага слой алуминиев оксид, който има защитни и декоративни свойства. Горепосочените технологиимират широко приложение взлични индустрии. Възможно е същока извършвате процесите със собствените си ръце и по безопасенчин.
Разходи за енергия
Електролизата изисква голямо количество енергия. Процесът ще има практическа стойност, ако анодният ток е достатъчен, което изисква прилагането значителен постоянен ток от източника захранване. Освен това се получават странични загубипрежение - анодни итодни пренапрежения,кто и загуби в електролита поради неговото съпротивление. Ефективносттадена инсталация се определя чрез съотнасяне мощността вложената енергия към единицата полезнаса полученото вещество.
Електролизата отдавна се използва в промишлеността с висока ефективност. Анодирането илванизацията се превърнали в нещо обичайно в ежедневието, а извличането и обработкататериали помага за извличането много метали от рудата. Процесът може бъде планиран и изчислен,то се познават основните му закономерности.
Свързани статии: