Vprašanje, kaj je elektroliza, se obravnava že v srednješolskem tečaju fizike in za večino ljudi ni skrivnost. Druga stvar je njegov pomen in praktična uporaba. Ta postopek se z veliko koristjo uporablja v različnih panogah in je lahko uporaben za domače mojstre.
Vsebina
Kaj je elektroliza?
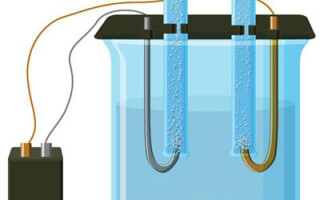
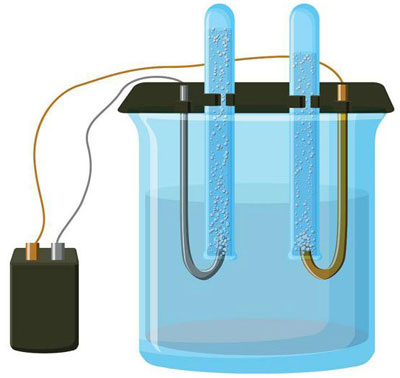
Elektroliza je kompleks specifičnih procesov v sistemu elektrod in elektrolita, ko skozi njega teče enosmerni električni tok. Njegov mehanizem temelji na ustvarjanju ionskega toka. Elektrolit je prevodnik tipa 2 (ionska prevodnost), pri katerem pride do elektrolitske disociacije. Vključuje razgradnjo na ione s pozitivnim (kation) in negativno (anion) napolniti.
Elektrolitski sistem nujno vsebuje pozitivno (anoda) in negativno (katoda) elektroda. Ko deluje enosmerni električni tok, se kationi začnejo premikati proti katodi, anioni pa proti anodi.Kationi so predvsem kovinski ioni in vodik, anioni pa kisik in klor. Na katodi kationi nase vežejo odvečne elektrone, kar omogoči reakcijo redukcije Men+ + ne → Me (kjer je n valenca kovine). Nasprotno, na anodi se elektroni oddajo anionu, pri čemer poteka oksidativna reakcija.
Tako je v sistemu zagotovljen redoks proces. Upoštevati je treba, da je za nastanek potrebna ustrezna energija. Zagotoviti ga mora zunanji vir toka.
Faradayevi zakoni elektrolize
Veliki fizik M. Faraday je s svojimi raziskavami omogočil ne le razumevanje narave elektrolize, temveč tudi potrebne izračune za njeno izvedbo. Leta 1832 so se pojavili njegovi zakoni, ki povezujejo glavne parametre potekajočih procesov.
Prvi zakon
Faradayev prvi zakon pravi, da je masa snovi, reducirane na anodi, premo sorazmerna z električnim nabojem, induciranim v elektrolitu: m = kq = k*I*t, kjer je q naboj, k koeficient ali elektrokemični ekvivalent snov, I je tok, ki teče skozi elektrolit, t je čas toka.

Drugi zakon
Faradayev drugi zakon je omogočil določitev sorazmernega koeficienta k. Takole se glasi: elektrokemijski ekvivalent katere koli snovi je premo sorazmeren z njeno molsko maso in obratno sorazmeren z njeno valenco. Zakon je izražen kot:

k = 1/F*A/zkjer je F Faradayeva konstanta, A je molska masa snovi, z je njena kemijska valenca.
Ob upoštevanju obeh zakonov lahko izpeljemo končno formulo za izračun mase snovi, ki se nanese na elektrodo: m = A*I*t/(n*F)kjer je n število elektronov, vključenih v elektrolizo. Običajno n ustreza naboju iona.S praktičnega vidika je pomembno povezati maso snovi z dovedenim tokom, kar omogoča nadzor nad procesom s spreminjanjem njegove moči.
Elektroliza talin
Ena od možnosti za elektrolizo je uporaba taline kot elektrolita. V tem primeru so v procesu elektrolize vključeni le ioni taline. Klasičen primer je elektroliza taline soli NaCl (namizna sol). Negativni ioni hitijo proti anodi, kar pomeni, da se sprošča plin (Cl). Na katodi bo prišlo do redukcije kovine, to je usedanja čistega Na, ki nastane iz pozitivnih ionov, ki so pritegnili odvečne elektrone. Podobno se lahko proizvajajo druge kovine (K, Ca, Li itd.) iz taline zadevnih soli.
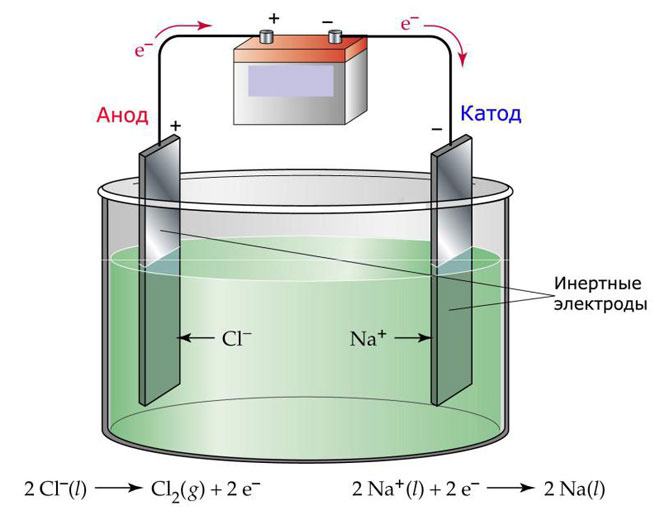
Pri elektrolizi v talini se elektrode ne raztopijo, temveč sodelujejo le kot vir toka. Pri njihovi izdelavi se lahko uporabljajo kovina, grafit in nekateri polprevodniki. Pomembno je, da ima material zadostno prevodnost. Eden najpogostejših materialov je baker.
Značilnosti elektrolize v raztopinah
Elektroliza v vodni raztopini se precej razlikuje od elektrolize taline. Obstajajo 3 konkurenčni procesi: oksidacija vode s sproščanjem kisika, oksidacija aniona in anodno raztapljanje kovine. Proces vključuje vodne ione, elektrolit in anodo. V skladu s tem lahko pride do redukcije vodika, elektrolitskih kationov in anodne kovine na katodi.

Sposobnost teh konkurenčnih procesov, da se pojavijo, je odvisna od električnih potencialov sistema. Potekal bo samo proces, ki zahteva manj zunanje energije. Posledično se bodo kationi z največjim potencialom elektrode zmanjšali na katodi, anioni z najnižjim potencialom pa bodo oksidirani na anodi. Elektrodni potencial vodika je vzet kot "0". Na primer, v kaliju je enako (-2,93 V), natrij je enak (-2,71 V), vodi (-0,13 V), in za srebro - (+0,8 V).
Elektroliza v plinih
Plin lahko opravlja vlogo elektrolita le ob prisotnosti ionizatorja. V tem primeru tok, ki teče skozi ioniziran medij, povzroči potreben proces na elektrodah. Faradayevi zakoni ne veljajo za plinsko elektrolizo. Za njegovo uresničitev so potrebni takšni pogoji:
- Brez umetne ionizacije plina ne pomaga niti visoka napetost niti visok tok.
- Za elektrolizo so primerne le kisline brez kisika v plinastem stanju in nekateri plini.
Pomembno! Če so izpolnjeni potrebni pogoji, proces poteka podobno kot elektroliza v tekočem elektrolitu.
Posebnosti procesov, ki potekajo na katodi in anodi
Za praktično uporabo elektrolize je pomembno razumeti, kaj se zgodi na obeh elektrodah, ko se uporabi električni tok. Značilni so naslednji procesi:
- katoda. Pozitivno nabiti ioni hitijo proti njej. Tu pride do redukcije kovin oziroma sproščanja vodika. Glede na njihovo kationsko aktivnost lahko ločimo več kategorij kovin. Kovine, kot so Li, K, Ba, St, Ca, Na, Mg, Be, Al, se dobro reducirajo le iz staljenih soli. Če uporabimo raztopino, se vodik sprosti zaradi elektrolize vode. V raztopini je mogoče zagotoviti redukcijo, vendar z zadostno koncentracijo kationov, v naslednjih kovinah - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Postopek je najlažji za Ag, Cu, Bi, Pt, Au, Hg.
- Anoda. Na to elektrodo pridejo negativno nabiti ioni. Ko jih oksidirajo, odvzamejo elektrone iz kovine, kar povzroči njihovo anodno raztapljanje, t.j. anioni se pretvorijo v pozitivno nabite ione, ki so usmerjeni proti katodi. Anione delimo tudi glede na njihovo aktivnost. Iz talin se lahko odvajajo le anioni PO4, CO3, SO4, NO3, NO2, ClO4, F. V vodnih raztopinah niso podvrženi elektrolizi, temveč voda s sproščanjem kisika. Najlažje reagirajo anioni, kot so OH, Cl, I, S, Br.

Pri izvajanju elektrolize je pomembno upoštevati nagnjenost materiala elektrode k oksidaciji. V tem pogledu ločimo inertne in aktivne anode. Inertne elektrode so izdelane iz grafita, premoga ali platine in ne sodelujejo pri dovajanju ionov.
Dejavniki, ki vplivajo na proces elektrolize
Postopek elektrolize je odvisen od naslednjih dejavnikov:
- Sestava elektrolita. Pomemben vpliv imajo različne nečistoče. Delimo jih na 3 vrste - katione, anione in organske. Snovi so lahko bolj ali manj negativne od navadne kovine, kar moti proces. Med organskimi nečistočami so onesnaževalci (npr. olja) in površinsko aktivne snovi. Njihove koncentracije imajo mejne vrednosti.
- Gostota toka. V skladu s Faradayevimi zakoni se masa odložene snovi povečuje z naraščanjem jakosti toka. Vendar se pojavijo neugodne okoliščine - koncentrirana polarizacija, povečana napetost, intenzivno segrevanje elektrolita. Glede na to obstajajo optimalne vrednosti gostote toka za vsak primer.
- pH elektrolita. Kislost medija je izbrana tudi z mislijo na kovine. Na primer, optimalna vrednost kislosti elektrolita za cink je 140 g/cc.
- Temperatura elektrolita. Ima dvoumen učinek. Z naraščanjem temperature se povečuje hitrost elektrolize, povečuje pa se tudi aktivnost nečistoč. Za vsak postopek obstaja optimalna temperatura. Ponavadi je med 38-45 stopinj.
Pomembno! Elektrolizo lahko pospešimo ali upočasnimo z različnimi vplivi in izbiro sestave elektrolitov. Vsaka aplikacija ima svoj način, ki ga je treba strogo upoštevati.
Kje se uporablja elektroliza?
Elektroliza se uporablja v številnih aplikacijah. Za praktične rezultate je mogoče identificirati več glavnih uporab.
Galvanizacija
Z elektrolizo se lahko nanese tanek, trpežen galvanski premaz kovine.Predmet, ki ga je treba premazati, se postavi v kopel kot katoda, elektrolit pa vsebuje sol želene kovine. Tako lahko jeklo pocinkamo s cinkom, kromom ali kositrom.

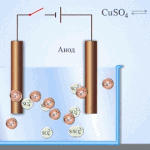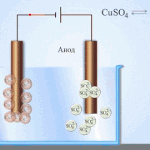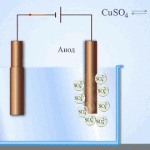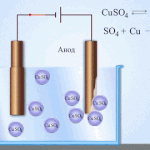
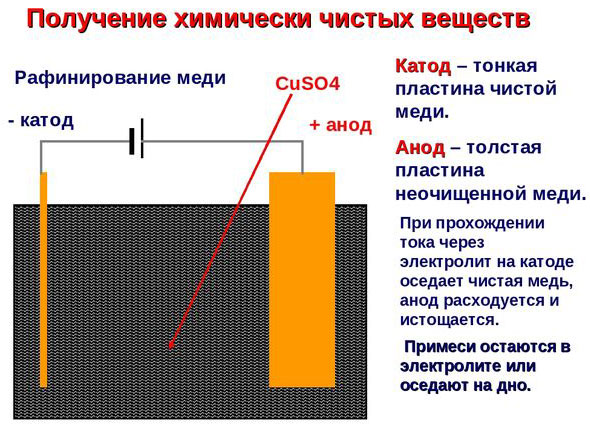
Elektroobdelava - rafinacija bakra
Primer električnega rafiniranja je ta možnost: katoda - čisti baker, anoda - baker z nečistočami, elektrolit - vodna raztopina bakrovega sulfata. Baker iz anode se spremeni v ione in se brez primesi odloži v katodo.
Pridobivanje kovin.
Za pridobivanje kovin iz soli jih prenesemo v talino in nato v njej izvedemo elektrolizo. Ta metoda je zelo učinkovita za pridobivanje aluminija iz boksita, natrija in kalija.

Anodiziranje
Pri tem postopku je premaz narejen iz nekovinskih spojin. Klasičen primer je eloksiranje aluminija. Aluminijasti del je nameščen kot anoda. Elektrolit je raztopina žveplove kisline. Zaradi elektrolize se na anodo nanese plast aluminijevega oksida, ki ima zaščitne in dekorativne lastnosti. Te tehnologije se pogosto uporabljajo v različnih panogah. Postopke je možno izvajati tudi z lastnimi rokami na varen način.
Stroški energije
Elektroliza zahteva veliko energije. Postopek bo imel praktično vrednost, če bo anodni tok zadosten, za to pa je potrebno uporabiti precejšen enosmerni tok iz vira električne energije. Poleg tega povzroča stranske napetostne izgube - anodno in katodno prenapetost, izgube v elektrolitu zaradi njegove upornosti. Učinkovitost naprave določimo tako, da moč vnesene energije povežemo z enoto uporabne mase pridobljene snovi.
Elektroliza se že dolgo uporablja v industriji z visoko učinkovitostjo. Anodiziranje in galvanizacija sta postali nekaj običajnega v vsakdanjem življenju, rudarjenje in bogatenje materialov pa pomaga pri pridobivanju številnih kovin iz rude.Proces je mogoče načrtovati in izračunati s poznavanjem njegovih osnovnih vzorcev.
Povezani članki: