Pogosto je težava določiti, katera elektroda je katoda in katera anoda. Za začetek moramo razumeti izraze.
Vsebina
Koncept katode in anode – preprosta razlaga
V kompleksnih snoveh elektroni med atomi v spojinah niso enakomerno porazdeljeni. Zaradi interakcije se delci premaknejo iz atoma ene snovi v atom druge snovi. Reakcijo imenujemo redoks reakcija. Izgubo elektronov imenujemo oksidacija, element, ki odda elektrone, pa redukcijsko sredstvo.
Dodajanje elektronov imenujemo redukcija; element, ki v tem procesu prevzame elektrone, je oksidant. Prenos elektronov od reducenta do oksidanta lahko teče skozi zunanji tokokrog, nato pa se lahko uporabi kot vir električne energije. Naprave, v katerih se energija kemijske reakcije pretvarja v električno energijo, imenujemo galvanski členi.
Najenostavnejši klasični primer galvanskega člena sta dve plošči iz različnih kovin in potopljeni v raztopino elektrolita.V takem sistemu na eni kovini pride do oksidacije, na drugi pa do redukcije.
POMEMBNO! Elektroda, kjer poteka oksidacija, se imenuje anoda. Elektroda, kjer poteka redukcija, se imenuje katoda.
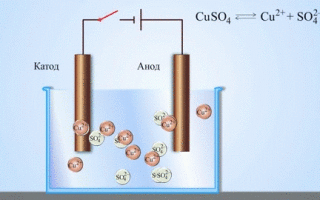
Iz šolskih učbenikov kemije poznamo primer bakreno-cinkovega galvanskega člena, ki deluje zaradi energije reakcije med cinkom in bakrovim sulfatom. Pri Jacoby-Danielovi napravi bakreno ploščo postavimo v raztopino bakrovega sulfata (bakrovo elektrodo), cinkovo ploščo pa potopimo v raztopino cinkovega sulfata (cinkova elektroda). Cinkova elektroda oddaja katione v raztopino in v njej ustvari presežek pozitivnega naboja, medtem ko je pri bakreni elektrodi raztopina osiromašena s kationi, tu je raztopina negativno nabita.
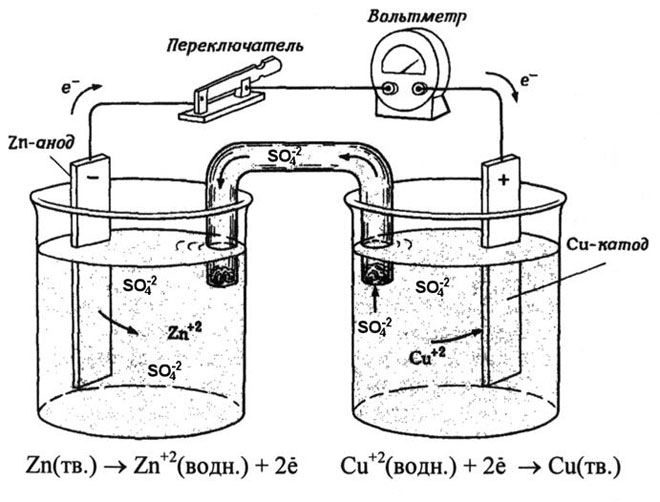
Zaprtje zunanjega tokokroga povzroči pretok elektronov od cinkove elektrode k bakreni elektrodi. Ravnotežna razmerja na faznih mejah so prekinjena. Poteka redoks reakcija.
Energija spontane kemične reakcije se spremeni v električno energijo.
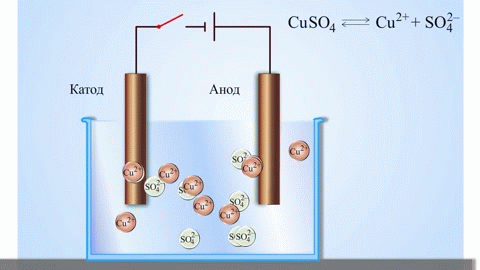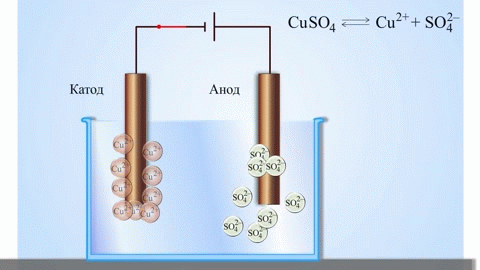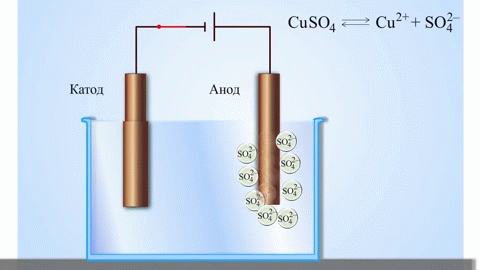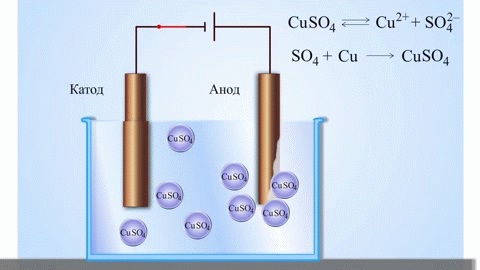
Če kemijsko reakcijo izzove zunanja energija električnega toka, pride do procesa, imenovanega elektroliza. Procesi, vključeni v elektrolizo, so obratni od tistih, ki sodelujejo pri delovanju galvanskega člena.
OPOZORILO. Elektroda, kjer poteka redukcija, se imenuje tudi katoda, vendar je pri elektrolizi negativno nabita, anoda pa pozitivno.
Elektrokemijske aplikacije
Anode in katode sodelujejo v številnih kemičnih reakcijah:
- elektroliza;
- Elektro ekstrakcija;
- Galvanizacija;
- Galvanizacija.
Z elektrolizo staljenih spojin in vodnih raztopin nastanejo kovine, očistijo kovine nečistoč in izločijo dragocene komponente (elektrolitsko rafiniranje). Plošče so ulite iz kovine, ki jo je treba oplemenititi. Plošče so nameščene kot anode v elektrolizerju. Kovina se raztopi z električnim tokom.Njegovi kationi prehajajo v raztopino in se izpraznijo na katodi, pri čemer tvorijo oborino čiste kovine. Nečistoče v prvotni surovi kovinski plošči bodisi ostanejo netopne v obliki anodnega blata bodisi preidejo v elektrolit, iz katerega se odstranijo. Baker, nikelj, svinec, zlato, srebro in kositer so izpostavljeni elektrolitskemu rafiniranju.
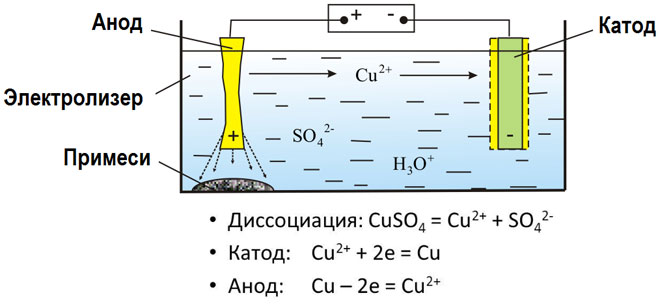
Elektroekstrakcija je postopek pridobivanja kovine iz raztopine med elektrolizo. Kovina je obdelana s posebnimi reagenti, da preide v raztopino. Med postopkom se na katodi sprosti kovina visoke čistosti. Tako nastajajo cink, baker in kadmij.
Da bi preprečili korozijo, dali moč in okrasili izdelek, je površina ene kovine prekrita s plastjo druge. Ta postopek se imenuje galvanizacija.

Galvanizacija je postopek izdelave kovinskih kopij tridimenzionalnih predmetov z elektrodepozicijo kovine.

Uporaba v vakuumskih elektronskih napravah
Načelo delovanja katode in anode v vakuumskem aparatu lahko prikažemo z elektronsko cevjo. Videti je kot hermetično zaprta posoda s kovinskimi deli v notranjosti. Naprava se uporablja za popravljanje, ustvarjanje in pretvorbo električnih signalov. Glede na število elektrod ločimo:
- diode;
- triode;
- tetrode;
- pentode itd.
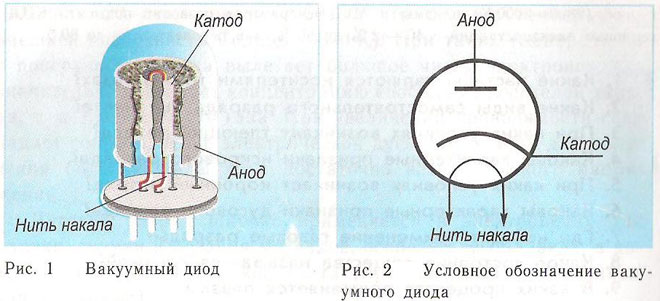
Dioda je vakuumska naprava z dvema elektrodama, katodo in anodo. Katoda je priključena na negativni pol napajalnika, anoda pa na pozitivni pol. Namen katode je oddajanje elektronov pod vplivom električnega toka, ki se segreje na določeno temperaturo. Z oddanimi elektroni se med katodo in anodo ustvari prostorski naboj. Najhitrejši elektroni hitijo do anode in premagajo negativno potencialno oviro prostorskega naboja. Anoda sprejme te delce. Ustvari se anodni tok v zunanjem tokokrogu.Tok elektronov se krmili z dodatnimi elektrodami, tako da se nanje napaja električni potencial. Diode se uporabljajo za pretvorbo izmeničnega toka v enosmerni.
Elektronske aplikacije
Danes se uporabljajo polprevodniške vrste diod.
Lastnost diod, da prepuščajo tok v smeri naprej in ne prepuščajo toka v obratni smeri, se pogosto uporablja v elektroniki.
Delovanje LED temelji na lastnosti polprevodniških kristalov, da svetijo, ko tok teče skozi p-n spoj v smeri naprej.
Galvanski viri enosmernega toka - akumulatorji
Kemični viri električnega toka, v katerih potekajo reverzibilne reakcije, se imenujejo polnilne baterije: polnijo se in uporabljajo večkrat.

Ko svinčena baterija deluje, pride do redoks reakcije. Kovinski svinec oksidira, odda svoje elektrone in reducira svinčev dioksid, ki sprejme elektrone. Kovinski svinec v bateriji je anoda in je negativno nabit. Svinčev dioksid je katoda in je pozitivno nabit.
Ko se baterija prazni, se snovi katode in anode ter njun elektrolit, žveplova kislina, porabijo. Za polnjenje baterije je priključena na vir toka (plus na plus, minus na minus). Smer toka je zdaj nasprotna tisti, ki je bila, ko je bil akumulator izpraznjen. Elektrokemični procesi na elektrodah so »obrnjeni«. Zdaj postane svinčena elektroda katoda, na njej poteka proces redukcije, svinčev dioksid pa postane anoda, pri čemer poteka postopek oksidacije. Snovi, ki so potrebne za delovanje baterije, se ponovno ustvarijo v bateriji.
Zakaj prihaja do zmede?
Težava nastane, ker določenega znaka naboja ni mogoče trdno pritrditi na anodo ali katodo. Pogosto je katoda pozitivno nabita elektroda, anoda pa negativna elektroda. Pogosto, vendar ne vedno.Vse je odvisno od procesa, ki poteka na elektrodi.
OPOZORILO. Del, ki ga vstavite v elektrolit, je lahko anoda in katoda. Vse je odvisno od namena postopka: nanesti drugo plast kovine ali jo odstraniti.
Kako določiti anodo in katodo
V elektrokemiji je anoda elektroda, kjer potekajo oksidacijski procesi, katoda pa elektroda, kjer poteka redukcija.
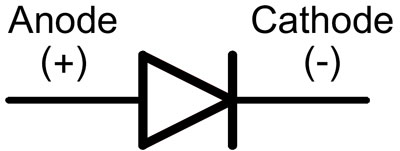
V diodi se vodi imenujeta anoda in katoda. Tok bo tekel skozi diodo, če je »anodni« vod priključen na »plus«, »katodni« vod pa na »minus«.
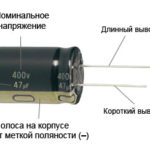
Pri novi LED z neobrezanimi nožicami sta anoda in katoda določeni vizualno glede na dolžino. Katoda je krajša.

Če so kontakti prerezani, vam bo pomagala pritrjena baterija. Lučka se bo pojavila, ko se polariteti ujemata.
Znak anode in katode
V elektrokemiji je pravilneje govoriti ne o znakih nabojev elektrod, temveč o procesih, ki se na njih odvijajo. Reakcija redukcije poteka na katodi, reakcija oksidacije pa na anodi.
V elektrotehniki je za pretok toka katoda povezana z negativnim polom tokovnega vira, anoda pa s pozitivnim polom.
Povezani članki: