Sageli on probleem kindlaks teha, milline elektrood on katood ja milline anood. Alustuseks peame mõistma mõisteid.
Sisu
Katoodi ja anoodi mõiste – lihtne seletus
Keerulistes ainetes ei ole ühendites aatomitevahelised elektronid ühtlaselt jaotunud. Interaktsiooni tulemusena liiguvad osakesed ühe aine aatomilt teise aine aatomisse. Reaktsiooni nimetatakse redoksreaktsiooniks. Elektronide kadu nimetatakse oksüdatsiooniks, elektrone loovutavat elementi redutseerijaks.
Elektronide liitmist nimetatakse redutseerimiseks; element, mis selles protsessis elektrone võtab, on oksüdeerija. Elektronide ülekandmine redutseerijalt oksüdeerivale ainele võib voolata läbi välise vooluringi ja seejärel saab seda kasutada elektrienergia allikana. Seadmeid, milles keemilise reaktsiooni energia muundatakse elektrienergiaks, nimetatakse galvaanilisteks elementideks.
Kõige lihtsam klassikaline galvaanilise elemendi näide on kaks erinevatest metallidest valmistatud plaati, mis on kastetud elektrolüüdilahusesse.Sellises süsteemis toimub ühel metallil oksüdatsioon ja teisel redutseerimine.
TÄHTIS! Elektroodi, kus oksüdatsioon toimub, nimetatakse anoodiks. Elektroodi, kus redutseerimine toimub, nimetatakse katoodiks.
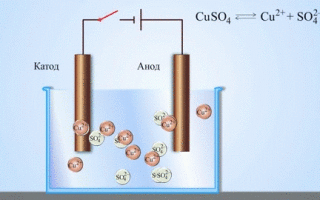
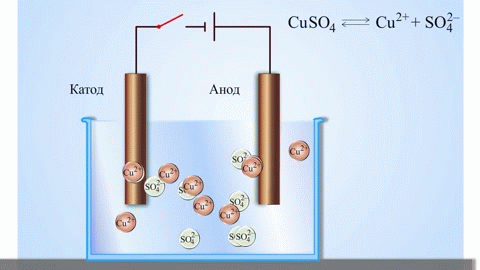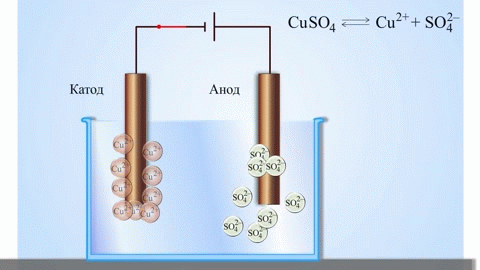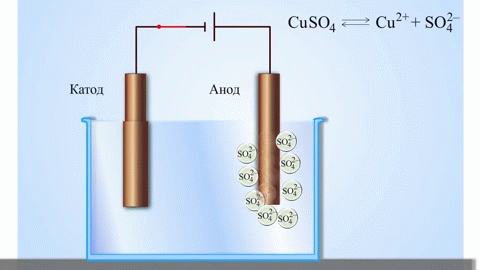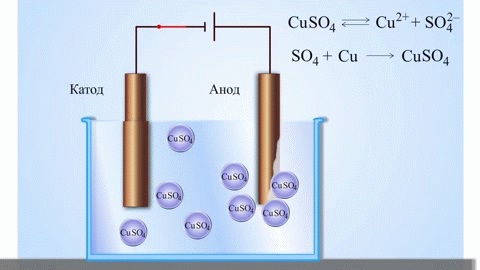
Koolikeemia õpikutest teame näidet vask-tsink-galvaanielemendist, mis töötab tänu tsingi ja vasksulfaadi vahelise reaktsiooni energiale. Jacoby-Danieli seadmes asetatakse vaskplaat vasksulfaadi lahusesse (vaskelektrood) ja tsinkplaat sukeldatakse tsinksulfaadi lahusesse (tsinkelektrood). Tsinkelektrood eraldab lahusesse katioone, tekitades selles liigse positiivse laengu, samas kui vaskelektroodil on lahus katioonidest tühi, siin on lahus negatiivselt laetud.
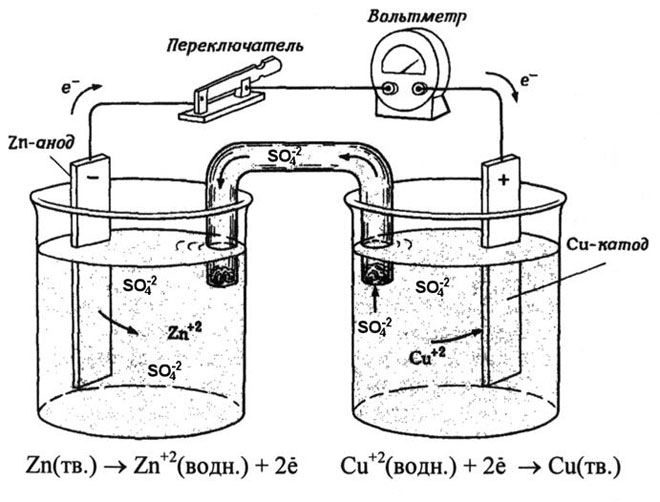
Välisahela sulgemine põhjustab elektronide voolu tsinkelektroodilt vaskelektroodile. Tasakaalusuhted faasipiiridel katkevad. Toimub redoksreaktsioon.
Spontaanse keemilise reaktsiooni energia muutub elektrienergiaks.
Kui keemilise reaktsiooni kutsub esile elektrivoolu välisenergia, toimub protsess, mida nimetatakse elektrolüüsiks. Elektrolüüsiga seotud protsessid on vastupidised galvaanilise elemendi töös osalevatele protsessidele.
HOIATUS. Elektroodi, kus toimub redutseerimine, nimetatakse ka katoodiks, kuid elektrolüüsil on see negatiivselt ja anood positiivselt laetud.
Elektrokeemilised rakendused
Anoodid ja katoodid osalevad paljudes keemilistes reaktsioonides:
- elektrolüüs;
- Elektriline ekstraheerimine;
- galvaniseerimine;
- Galvaneerimine.
Sulaühendite ja vesilahuste elektrolüüsil saadakse metalle, puhastatakse metallid lisanditest ja ekstraheeritakse väärtuslikke komponente (elektrolüütiline rafineerimine). Plaadid valatakse rafineeritavast metallist. Plaadid asetatakse anoodidena elektrolüsaatorisse. Metall lahustub elektrivoolu toimel.Selle katioonid lähevad lahusesse ja tühjendatakse katoodil, moodustades puhta metalli sademe. Algses toormetallplaadis sisalduvad lisandid jäävad anoodsete mudana lahustumatuks või lähevad elektrolüüti, kust need eemaldatakse. Vask, nikkel, plii, kuld, hõbe ja tina läbivad elektrolüütilise rafineerimise.
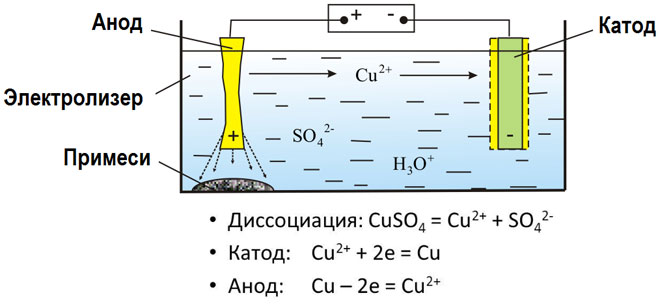
Elektroekstraktsioon on metalli ekstraheerimine lahusest elektrolüüsi käigus. Metalli töödeldakse spetsiaalsete reaktiividega, et see lahustuks. Protsessi käigus eraldub katoodil kõrge puhtusastmega metall. Nii toodetakse tsinki, vaske ja kaadmiumi.
Korrosiooni vältimiseks, tugevuse andmiseks ja toote kaunistamiseks kaetakse ühe metalli pind teise metalli kihiga. Seda protsessi nimetatakse galvaniseerimiseks.

Galvaneerimine on protsess, mille käigus tehakse kolmemõõtmelistest objektidest metallist koopiaid metalli elektro-sadestamise teel.

Kasutamine vaakumelektroonilistes seadmetes
Katoodi ja anoodi põhimõtet vaakumseadmes saab demonstreerida elektrontoru abil. See näeb välja nagu hermeetiliselt suletud anum, mille sees on metallosad. Seadet kasutatakse elektriliste signaalide alaldamiseks, genereerimiseks ja teisendamiseks. Elektroodide arvu järgi eristatakse:
- dioodid;
- trioodid;
- tetroodid;
- pentoodid jne.
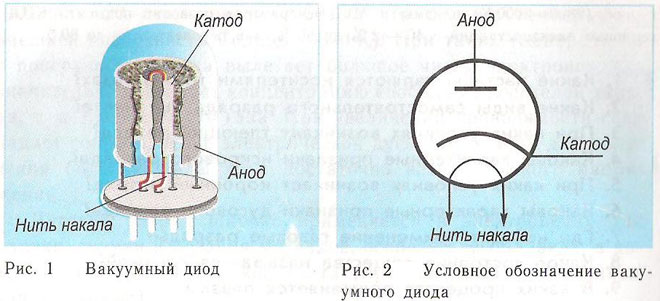
Diood on vaakumseade, millel on kaks elektroodi, katood ja anood. Katood on ühendatud toiteallika negatiivse poolusega, anood positiivse poolusega. Katoodi eesmärk on elektronide eraldamine elektrivoolu kuumutamise mõjul teatud temperatuurini. Emiteeritud elektronide kaudu tekib katoodi ja anoodi vahele ruumiline laeng. Kiireimad elektronid tormavad anoodile, ületades ruumilaengu negatiivse potentsiaalbarjääri. Anood võtab need osakesed vastu. Välisahelas tekib anoodvool.Elektronide voolu juhitakse täiendavate elektroodide abil, rakendades neile elektripotentsiaali. Dioode kasutatakse vahelduvvoolu muutmiseks alalisvooluks.
Elektroonikarakendused
Tänapäeval kasutatakse pooljuhtdioode.
Elektroonikas kasutatakse laialdaselt dioodide omadust juhtida voolu edasi ja mitte suunata voolu vastupidises suunas.
LED-i töö põhineb pooljuhtkristallide omadusel hõõguda, kui vool läbib p-n-siirde edasisuunas.
Alalisvoolu galvaanilised allikad - akud
Elektrivoolu keemilisi allikaid, milles toimuvad pöörduvad reaktsioonid, nimetatakse taaslaetavateks akudeks: neid laetakse ja kasutatakse korduvalt.

Kui pliiaku töötab, toimub redoksreaktsioon. Metallplii oksüdeerub, loobudes oma elektronidest, vähendades pliidoksiidi, mis elektronid vastu võtab. Aku metallplii on anood ja on negatiivselt laetud. Pliidioksiid on katood ja on positiivselt laetud.
Aku tühjenemisel kuluvad katoodi ja anoodi ained ning nende elektrolüüt väävelhape. Aku laadimiseks ühendatakse see vooluallikaga (pluss pluss, miinus miinus). Voolu suund on nüüd vastupidine sellele, mis oli aku tühjenemise ajal. Elektroodidel toimuvad elektrokeemilised protsessid on "pööratud". Nüüd muutub pliielektrood katoodiks, sellel toimub redutseerimisprotsess ja pliidioksiid muutub anoodiks, kusjuures toimub oksüdatsiooniprotseduur. Akusse tekivad jällegi aku töötamiseks vajalikud ained.
Miks on segadus?
Probleem tekib seetõttu, et konkreetset laengumärki ei saa anoodi või katoodi külge kindlalt kinnitada. Sageli on katood positiivselt laetud elektrood ja anood negatiivne elektrood. Sageli, kuid mitte alati.Kõik sõltub elektroodi juures toimuvast protsessist.
HOIATUS. Elektrolüüti pandav osa võib olla nii anood kui ka katood. Kõik oleneb protsessi eesmärgist: kas panna peale veel üks metallikiht või ära võtta.
Kuidas määrata anood ja katood
Elektrokeemias on anood elektrood, kus toimuvad oksüdatsiooniprotsessid, ja katood on elektrood, kus toimub redutseerimine.
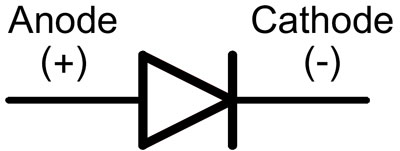
Dioodis nimetatakse juhtmeid anoodiks ja katoodiks. Vool voolab läbi dioodi, kui "anoodi" juhe on ühendatud "plussiga" ja "katoodi" juhe on ühendatud "miinusega".
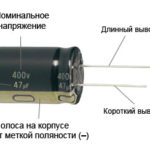
Uue lõikamata tihvtidega LED-i puhul määratakse anood ja katood visuaalselt pikkuse järgi. Katood on lühem.

Kui kontaktid on läbi lõigatud, aitab nende külge kinnitatud aku. Tuli ilmub siis, kui polaarsused ühtivad.
Anoodi ja katoodi märk
Elektrokeemias on õigem rääkida mitte elektroodide laengute tunnustest, vaid nendel toimuvatest protsessidest. Redutseerimisreaktsioon toimub katoodil ja oksüdatsioonireaktsioon anoodil.
Elektrotehnikas ühendatakse voolu voolamiseks katood vooluallika negatiivse poolusega, anood positiivse poolusega.
Seotud artiklid: