Küsimust, mis on elektrolüüs, käsitletakse juba keskkooli füüsikakursuse ajal ja see pole enamiku inimeste jaoks saladus. Teine asi on selle tähtsus ja praktiline rakendamine. Sellest protsessist on palju kasu erinevates tööstusharudes ja see võib olla kasulik kodumeistrile.
Sisu
Mis on elektrolüüs?
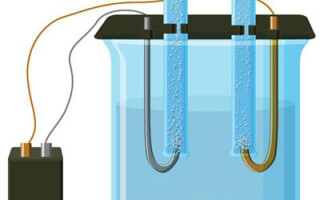
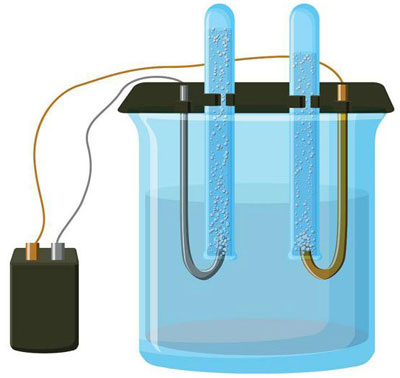
Elektrolüüs on spetsiifiliste protsesside kompleks elektroodide ja elektrolüüdi süsteemis, kui seda läbib alalisvool. Selle mehhanism põhineb ioonvoolu genereerimisel. Elektrolüüt on 2. tüüpi juht (ioonjuhtivus), mille puhul toimub elektrolüütiline dissotsiatsioon. See hõlmab lagunemist ioonideks, millel on positiivne (katioon) ja negatiivne (anioon) tasu.
Elektrolüütiline süsteem sisaldab tingimata positiivset (anood) ja negatiivne (katood) elektrood. Kui rakendatakse alalisvoolu, hakkavad katioonid liikuma katoodi ja anioonid anoodi poole.Katioonid on peamiselt metalliioonid ja vesinik ning anioonideks hapnik ja kloor. Katoodil seovad katioonid enda külge liigsed elektronid, võimaldades redutseerimisreaktsiooni Men+ + ne → Me (kus n on metalli valents). Anoodil, vastupidi, anioonist loobutakse elektronid oksüdatiivse reaktsiooniga.
Seega on süsteemis tagatud redoksprotsess. Oluline on meeles pidada, et selle esinemiseks on vaja vastavat energiat. See peab olema tagatud välisest vooluallikast.
Faraday elektrolüüsi seadused
Suur füüsik M. Faraday võimaldas oma uurimistööga mitte ainult mõista elektrolüüsi olemust, vaid teha ka selle rakendamiseks vajalikke arvutusi. 1832. aastal ilmusid tema seadused, mis ühendasid toimuvate protsesside peamised parameetrid.
Esimene seadus
Faraday esimene seadus ütleb, et anoodil redutseeritava aine mass on otseselt võrdeline elektrolüüdis indutseeritud elektrilaenguga: m = kq = k*I*t, kus q on laeng, k on selle koefitsient või elektrokeemiline ekvivalent. aine, I on elektrolüüdi läbiv vool, t on voolu kulgemise aeg.

Teine seadus
Faraday teine seadus võimaldas määrata proportsionaalsuse koefitsiendi k. See kõlab järgmiselt: mis tahes aine elektrokeemiline ekvivalent on otseselt võrdeline selle molaarmassiga ja pöördvõrdeline selle valentsiga. Seadust väljendatakse järgmiselt:

k = 1/F*A/zkus F on Faraday konstant, A on aine molaarmass, z on selle keemiline valents.
Mõlemat seadust arvesse võttes saame tuletada lõpliku valemi elektroodile ladestunud aine massi arvutamiseks: m = A*I*t/(n*F)kus n on elektrolüüsis osalevate elektronide arv. Tavaliselt vastab n iooni laengule.Praktilisest seisukohast on oluline seostada aine massi tarnitava vooluga, mis võimaldab protsessi juhtida selle tugevuse muutmisega.
Sulandite elektrolüüs
Üks elektrolüüsi võimalus on kasutada elektrolüüdina sulamit. Sel juhul osalevad elektrolüüsi protsessis ainult sulamioonid. Klassikaline näide on soolasulami NaCl elektrolüüs (lauasool). Negatiivsed ioonid tormavad anoodi poole, mis tähendab gaasi eraldumist (Cl). Katoodil toimub metalli redutseerimine, st puhta Na settimine positiivsetest ioonidest, mis tõmbasid ligi liigseid elektrone. Samamoodi saab toota ka teisi metalle (K, Ca, Li jne.) vastavate soolade sulamist.
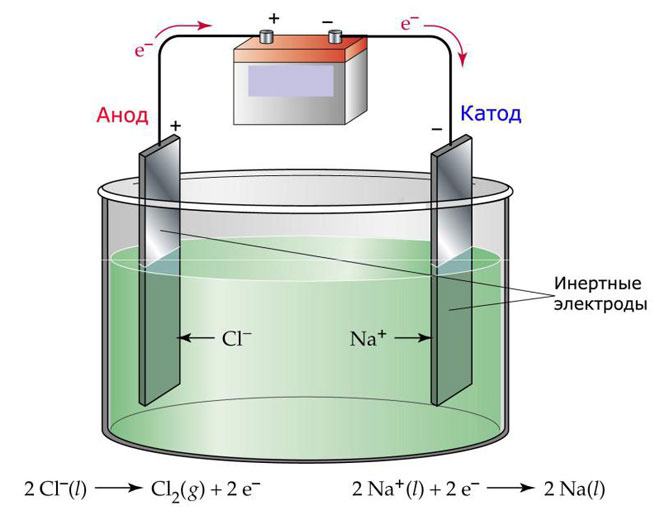
Elektrolüüsi käigus sulatis elektroodid ei lahustu, vaid osalevad ainult vooluallikana. Nende valmistamisel võib kasutada metalli, grafiiti ja mõningaid pooljuhte. Oluline on, et materjalil oleks piisav juhtivus. Üks levinumaid materjale on vask.
Elektrolüüsi omadused lahustes
Elektrolüüs vesilahuses erineb üsna palju sulamist. Seal on 3 konkureerivat protsessi: vee oksüdatsioon hapniku vabanemisega, aniooni oksüdatsioon ja metalli anoodne lahustumine. Protsess hõlmab veeioone, elektrolüüti ja anoodi. Sellest tulenevalt võib katoodil toimuda vesiniku, elektrolüüdi katioonide ja anoodimetalli redutseerimine.

Nende konkureerivate protsesside toimumise võime sõltub süsteemi elektrilistest potentsiaalidest. Edasi läheb ainult protsess, mis nõuab vähem välist energiat. Järelikult vähenevad katoodil maksimaalse elektroodipotentsiaaliga katioonid ja anoodil oksüdeeritakse madalaima potentsiaaliga anioonid. Vesiniku elektroodipotentsiaali võetakse kui "0". Näiteks kaaliumis on see võrdne (-2,93 В), naatrium võrdub (-2,71 В), plii (-0,13 В) ja hõbedale - (+0,8 В).
Elektrolüüs gaasides
Gaas võib täita elektrolüüdi rolli ainult ionisaatori juuresolekul. Sel juhul põhjustab ioniseeritud keskkonda läbiv vool elektroodidel vajaliku protsessi. Faraday seadused gaasielektrolüüsile ei kehti. Selle realiseerimiseks on vajalikud järgmised tingimused:
- Ilma gaasi kunstliku ioniseerimiseta ei aita ei kõrgepinge ega suur vool.
- Elektrolüüsiks sobivad ainult gaasilises olekus hapnikuvabad happed ja mõned gaasid.
Tähtis! Kui vajalikud tingimused on täidetud, kulgeb protsess sarnaselt elektrolüüsiga vedelas elektrolüüdis.
Katoodil ja anoodil toimuvate protsesside iseärasused
Elektrolüüsi praktiliseks rakendamiseks on oluline mõista, mis juhtub mõlema elektroodi juures, kui rakendatakse elektrivoolu. Iseloomulikud on järgmised protsessid:
- Katood. Positiivselt laetud ioonid tormavad selle poole. Siin toimub metallide redutseerimine või vesiniku vabanemine. Nende katioonse aktiivsuse järgi saab eristada mitut metallikategooriat. Metallid nagu Li, K, Ba, St, Ca, Na, Mg, Be, Al redutseeritakse hästi ainult sulasooladest. Lahuse kasutamisel eraldub vee elektrolüüsi tõttu vesinik. Lahuses on võimalik redutseerida, kuid piisava katioonide kontsentratsiooniga, järgmistes metallides - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Protsess on kõige lihtsam Ag, Cu, Bi, Pt, Au, Hg puhul.
- Anood. Sellele elektroodile jõuavad negatiivselt laetud ioonid. Neid oksüdeerides eemaldavad nad metallist elektronid, mis viib nende anoodilise lahustumiseni, st anioonid muudetakse positiivselt laetud ioonideks, mis on suunatud katoodi poole. Anioonid jagunevad ka nende aktiivsuse järgi. Sulamistest saab väljutada ainult PO4, CO3, SO4, NO3, NO2, ClO4, F anioone. Vesilahustes ei allutata need elektrolüüsile, vaid vesi koos hapniku vabanemisega. Anioonid nagu OH, Cl, I, S, Br reageerivad kõige kergemini.

Elektrolüüsi teostamisel on oluline arvestada elektroodi materjali kalduvust oksüdeeruda. Sellega seoses eristatakse inertseid ja aktiivseid anoode. Inertsed elektroodid on valmistatud grafiidist, kivisöest või plaatinast ja ei osale ioonide varustamisel.
Elektrolüüsi protsessi mõjutavad tegurid
Elektrolüüsi protsess sõltub järgmistest teguritest:
- Elektrolüüdi koostis. Olulist mõju avaldavad mitmesugused lisandid. Need jagunevad 3 tüüpi - katioonid, anioonid ja orgaanilised. Ained võivad olla rohkem või vähem negatiivsed kui mitteväärismetall, mis segab protsessi. Orgaaniliste lisandite hulka kuuluvad saasteained (nt õlid) ja pindaktiivsed ained. Nende kontsentratsioonidel on piirväärtused.
- Voolu tihedus. Faraday seaduste kohaselt suureneb ladestunud aine mass voolutugevuse kasvades. Siiski tekivad ebasoodsad asjaolud - kontsentreeritud polarisatsioon, pinge tõus, elektrolüüdi intensiivne kuumenemine. Seda silmas pidades on iga juhtumi jaoks olemas voolutiheduse optimaalsed väärtused.
- elektrolüüdi pH. Söötme happesus valitakse samuti metalle silmas pidades. Näiteks tsingi elektrolüüdi happesuse optimaalne väärtus on 140 g/cc.
- Elektrolüüdi temperatuur. Sellel on kahemõtteline mõju. Temperatuuri tõustes suureneb elektrolüüsi kiirus, aga ka lisandite aktiivsus. Iga protsessi jaoks on optimaalne temperatuur. Tavaliselt on see vahemikus 38-45 kraadi.
Tähtis! Elektrolüüsi saab kiirendada või aeglustada erinevate mõjude ja elektrolüüdi koostise valikuga. Igal rakendusel on oma režiim, mida tuleks rangelt järgida.
Kus kasutatakse elektrolüüsi?
Elektrolüüsi kasutatakse paljudes rakendustes. Praktiliste tulemuste saamiseks võib välja tuua mitu peamist kasutust.
Galvaneerimine
Elektrolüüsi teel saab peale kanda õhukese ja vastupidava galvaanilise metallikatte.Kattav ese asetatakse katoodina vanni ja elektrolüüt sisaldab soovitud metalli soola. Nii saab terast katta tsingi, kroomi või tinaga.

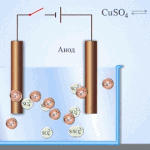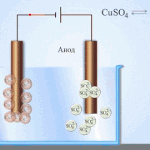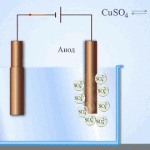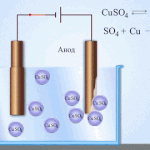
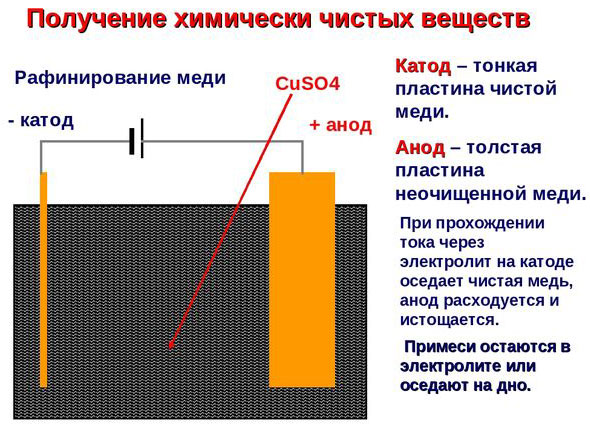
Elektrotöötlus – vase rafineerimine
Elektrilise rafineerimise näide on see valik: katood - puhas vask, anood - vask koos lisanditega, elektrolüüt - vasksulfaadi vesilahus. Anoodilt pärinev vask muutub ioonideks ja sadestub katoodile ilma lisanditeta.
Metalli ekstraheerimine.
Metallide saamiseks sooladest viiakse need sulatisse ja seejärel toimub selles elektrolüüs. See meetod on üsna tõhus alumiiniumi saamiseks boksiidist, naatriumist ja kaaliumist.

Anodeerimine
Selles protsessis valmistatakse kattekiht mittemetallilistest ühenditest. Klassikaline näide on alumiiniumi anodeerimine. Alumiiniumist osa on paigaldatud nagu anoodi. Elektrolüüt on väävelhappe lahus. Elektrolüüsi tulemusena sadestub anoodile alumiiniumoksiidi kiht, millel on kaitsvad ja dekoratiivsed omadused. Neid tehnoloogiaid kasutatakse laialdaselt erinevates tööstusharudes. Protsesse on võimalik ohutult läbi viia ka oma kätega.
Energiakulud
Elektrolüüs nõuab palju energiat. Protsess on praktilise väärtusega, kui anoodvool on piisav ja selleks on vaja rakendada elektriallikast märkimisväärset alalisvoolu. Lisaks tekitab see külgpingekadusid - anood- ja katoodliigpinget, kaod elektrolüüdis oma takistuse tõttu. Käitise kasutegur määratakse energiasisendi võimsuse seostamisel saadud aine kasuliku massi ühikuga.
Elektrolüüsi on tööstuses pikka aega kasutatud kõrge efektiivsusega. Anodeerimine ja galvaniseerimine on igapäevaelus muutunud tavapäraseks ning materjalide kaevandamine ja rikastamine aitab maagist välja tuua palju metalle.Protsessi saab planeerida ja arvutada, teades selle põhimustreid.
Seotud artiklid: