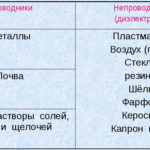
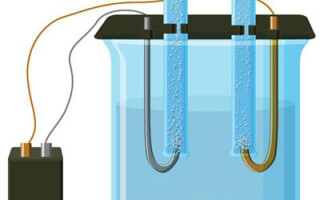
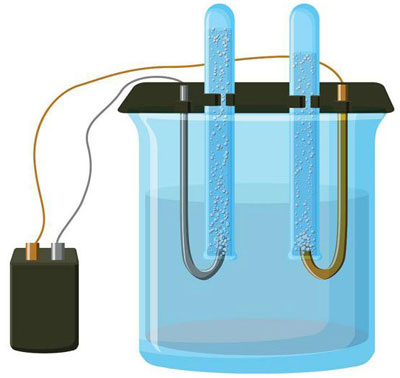
மின்னாற்பகுப்பு என்றால் என்ன என்ற கேள்வி உயர்நிலைப் பள்ளி இயற்பியல் பாடத்தின் ஆரம்பத்திலேயே கவனிக்கப்படுகிறது, மேலும் பெரும்பாலான மக்களுக்கு இது இரகசியமாக இல்லை. மற்றொரு விஷயம் அதன் முக்கியத்துவம் மற்றும் நடைமுறை பயன்பாடு. இந்த செயல்முறை பல்வேறு தொழில்களில் பெரும் நன்மையுடன் பயன்படுத்தப்படுகிறது மற்றும் வீட்டு கைவினைஞருக்கு பயனுள்ளதாக இருக்கும்.
உள்ளடக்கம்
- 1 மின்னாற்பகுப்பு என்றால் என்ன?
- 2 மின்னாற்பகுப்பின் ஃபாரடேயின் விதிகள்
- 3 உருகும் மின்னாற்பகுப்பு
- 4 தீர்வுகளில் மின்னாற்பகுப்பின் அம்சங்கள்
- 5 வாயுக்களில் மின்னாற்பகுப்பு
- 6 கேத்தோடு மற்றும் அனோடில் நிகழும் செயல்முறைகளின் அம்சங்கள்
- 7 மின்னாற்பகுப்பு செயல்முறையை பாதிக்கும் காரணிகள்
- 8 மின்னாற்பகுப்பு எங்கே பயன்படுத்தப்படுகிறது?
- 9 ஆற்றல் செலவுகள்
மின்னாற்பகுப்பு என்றால் என்ன?
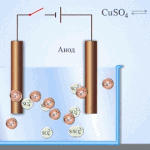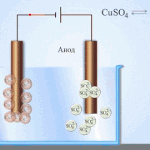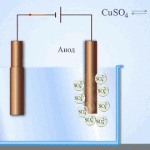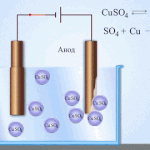
மின்னாற்பகுப்பு என்பது மின்முனைகள் மற்றும் எலக்ட்ரோலைட் அமைப்பில் ஒரு நேரடி மின்சாரம் பாயும் போது குறிப்பிட்ட செயல்முறைகளின் சிக்கலானது. அதன் பொறிமுறையானது அயனி மின்னோட்டத்தின் உருவாக்கத்தை அடிப்படையாகக் கொண்டது. எலக்ட்ரோலைட் ஒரு வகை 2 கடத்தி (அயனி கடத்துத்திறன்) இதில் மின்னாற்பகுப்பு விலகல் ஏற்படுகிறது. இது நேர்மறை கொண்ட அயனிகளாக சிதைவதை உள்ளடக்கியது (கேஷன்) மற்றும் எதிர்மறை (அயனி) கட்டணம்.
ஒரு மின்னாற்பகுப்பு அமைப்பு நேர்மறையைக் கொண்டிருக்க வேண்டும் (நேர்மின்முனை) மற்றும் எதிர்மறை (கத்தோட்) மின்முனை. ஒரு நேரடி மின்சாரம் பயன்படுத்தப்படும்போது, கேஷன்கள் கேத்தோடையும், அனான்கள் அனோடை நோக்கியும் நகரத் தொடங்குகின்றன.கேஷன்கள் முக்கியமாக உலோக அயனிகள் மற்றும் ஹைட்ரஜன், மற்றும் அனான்கள் ஆக்ஸிஜன் மற்றும் குளோரின் ஆகும். கேத்தோடில், கேஷன்கள் அதிகப்படியான எலக்ட்ரான்களை தங்களுக்குள் இணைத்து, குறைப்பு வினையை அனுமதிக்கிறது Men+ + ne → Me (இதில் n என்பது உலோகத்தின் மதிப்பு) நேர்மின்முனையில், மாறாக, எலக்ட்ரான்கள் ஆக்சிஜனேற்ற எதிர்வினை நடைபெறுவதால் அயனியில் இருந்து வெளியேறுகின்றன.
இதனால், ரெடாக்ஸ் செயல்முறை அமைப்பில் உறுதி செய்யப்படுகிறது. இது ஏற்படுவதற்கு, பொருத்தமான ஆற்றல் தேவை என்பதை நினைவில் கொள்வது அவசியம். இது வெளிப்புற மின்னோட்ட மூலத்தால் வழங்கப்பட வேண்டும்.
மின்னாற்பகுப்பின் ஃபாரடேயின் விதிகள்
சிறந்த இயற்பியலாளர் எம். ஃபாரடே, தனது ஆராய்ச்சியின் மூலம், மின்னாற்பகுப்பின் தன்மையைப் புரிந்துகொள்வது மட்டுமல்லாமல், அதைச் செயல்படுத்த தேவையான கணக்கீடுகளையும் செய்தார். 1832 ஆம் ஆண்டில் அவரது சட்டங்கள் தோன்றின, இது நடைபெறும் செயல்முறைகளின் முக்கிய அளவுருக்களை இணைக்கிறது.
முதல் சட்டம்
ஃபாரடேயின் முதல் விதியானது, அனோடில் குறைக்கப்பட்ட பொருளின் நிறை, எலக்ட்ரோலைட்டில் தூண்டப்பட்ட மின் கட்டணத்திற்கு நேர் விகிதாசாரமாகும் என்று கூறுகிறது: m = kq = k*I*t, இங்கு q என்பது சார்ஜ், k என்பது குணகம் அல்லது மின்வேதியியல் சமமான பொருள், I என்பது எலக்ட்ரோலைட் வழியாக பாயும் மின்னோட்டம், t என்பது மின்னோட்ட ஓட்டத்தின் நேரம்.

இரண்டாவது சட்டம்
ஃபாரடேயின் இரண்டாவது விதி விகிதாச்சாரத்தின் குணகத்தை தீர்மானிக்க முடிந்தது k. இது பின்வருமாறு கூறுகிறது: எந்தவொரு பொருளின் மின் வேதியியல் சமமானது அதன் மோலார் வெகுஜனத்திற்கு நேரடியாக விகிதாசாரமாகவும் அதன் வேலன்ஸ்க்கு நேர்மாறான விகிதாசாரமாகவும் இருக்கும். சட்டம் இவ்வாறு வெளிப்படுத்தப்படுகிறது:

k = 1/F*A/zF என்பது ஃபாரடேயின் மாறிலி, A என்பது பொருளின் மோலார் நிறை, z என்பது அதன் வேதியியல் மதிப்பு.
இரண்டு விதிகளையும் கணக்கில் எடுத்துக்கொண்டு, மின்முனையில் டெபாசிட் செய்யப்பட்ட பொருளின் நிறை கணக்கிடுவதற்கான இறுதி சூத்திரத்தை நாம் பெறலாம்: மீ = A*I*t/(n*F)இதில் n என்பது மின்னாற்பகுப்பில் ஈடுபடும் எலக்ட்ரான்களின் எண்ணிக்கை. பொதுவாக n என்பது அயனியின் மின்னூட்டத்திற்கு ஒத்திருக்கும்.நடைமுறைக் கண்ணோட்டத்தில், பொருளின் வெகுஜனத்தை வழங்கப்பட்ட மின்னோட்டத்துடன் தொடர்புபடுத்துவது முக்கியம், இது அதன் வலிமையை மாற்றுவதன் மூலம் செயல்முறையை கட்டுப்படுத்துவதை சாத்தியமாக்குகிறது.
உருகும் மின்னாற்பகுப்பு
மின்னாற்பகுப்புக்கான ஒரு விருப்பமானது உருகலை எலக்ட்ரோலைட்டாகப் பயன்படுத்துவதாகும். இந்த வழக்கில், உருகும் அயனிகள் மட்டுமே மின்னாற்பகுப்பு செயல்பாட்டில் ஈடுபட்டுள்ளன. ஒரு உன்னதமான உதாரணம் உப்பு உருகும் NaCl இன் மின்னாற்பகுப்பு (டேபிள் உப்பு) எதிர்மறை அயனிகள் அனோடை நோக்கி விரைகின்றன, அதாவது வாயு வெளியிடப்படுகிறது (Cl) கேத்தோடில் உலோகக் குறைப்பு இருக்கும், அதாவது அதிகப்படியான எலக்ட்ரான்களை ஈர்க்கும் நேர்மறை அயனிகளில் இருந்து உருவாகும் தூய Na நிலைநிறுத்தப்படும். இதேபோல், மற்ற உலோகங்கள் தயாரிக்கப்படலாம் (K, Ca, Li, முதலியன) அந்தந்த உப்புகளின் உருகலில் இருந்து.
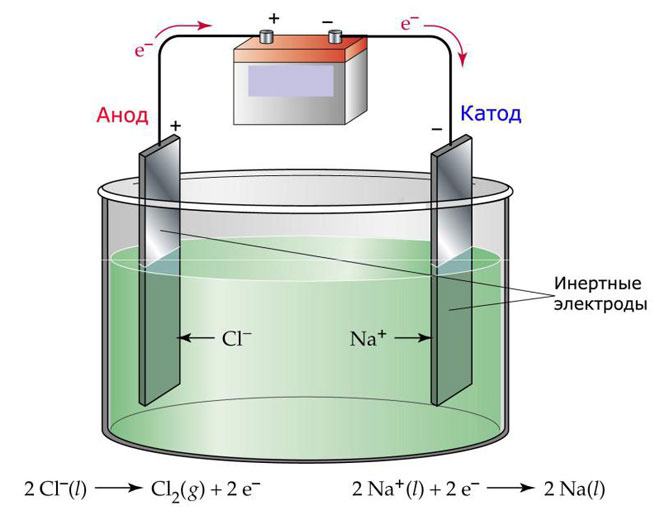
உருகலில் மின்னாற்பகுப்பின் போது, மின்முனைகள் கரைக்கப்படுவதில்லை, ஆனால் தற்போதைய ஆதாரமாக மட்டுமே பங்கேற்கின்றன. உலோகம், கிராஃபைட் மற்றும் சில குறைக்கடத்திகள் அவற்றின் உற்பத்தியில் பயன்படுத்தப்படலாம். பொருள் போதுமான கடத்துத்திறனைக் கொண்டிருப்பது முக்கியம். மிகவும் பொதுவான பொருட்களில் ஒன்று தாமிரம்.
தீர்வுகளில் மின்னாற்பகுப்பின் அம்சங்கள்
அக்வஸ் கரைசலில் மின்னாற்பகுப்பு உருகுவதில் இருந்து முற்றிலும் வேறுபட்டது. 3 போட்டி செயல்முறைகள் உள்ளன: ஆக்சிஜனை வெளியிடும் நீரின் ஆக்சிஜனேற்றம், அயனியின் ஆக்சிஜனேற்றம் மற்றும் உலோகத்தின் அனோடிக் கரைப்பு. செயல்முறை நீர் அயனிகள், எலக்ட்ரோலைட் மற்றும் அனோட் ஆகியவற்றை உள்ளடக்கியது. அதன்படி, ஹைட்ரஜன், எலக்ட்ரோலைட் கேஷன்கள் மற்றும் அனோட் உலோகத்தின் குறைப்பு கேத்தோடில் ஏற்படலாம்.

இந்த போட்டி செயல்முறைகளின் திறன் கணினியின் மின் ஆற்றல்களைப் பொறுத்தது. குறைந்த வெளிப்புற ஆற்றல் தேவைப்படும் செயல்முறை மட்டுமே தொடரும். இதன் விளைவாக, அதிகபட்ச மின்முனை திறன் கொண்ட கேஷன்கள் கேத்தோடில் குறைக்கப்படும், மேலும் குறைந்த ஆற்றல் கொண்ட அனான்கள் அனோடில் ஆக்ஸிஜனேற்றப்படும். ஹைட்ரஜனின் மின்முனை திறன் "0" ஆக எடுத்துக் கொள்ளப்படுகிறது. எடுத்துக்காட்டாக, பொட்டாசியத்தில் இது சமம் (-2,93 வி), சோடியம் சமம் (-2,71 வி), வழி நடத்து (-0,13 வி), மற்றும் வெள்ளிக்கு - (+0,8 வி).
வாயுக்களில் மின்னாற்பகுப்பு
ஒரு வாயு ஒரு அயனியாக்கியின் முன்னிலையில் மட்டுமே எலக்ட்ரோலைட்டின் பங்கைச் செய்ய முடியும். இந்த வழக்கில், அயனியாக்கம் செய்யப்பட்ட ஊடகத்தின் வழியாக செல்லும் மின்னோட்டம் மின்முனைகளில் தேவையான செயல்முறையை ஏற்படுத்துகிறது. ஃபாரடே விதிகள் வாயு மின்னாற்பகுப்புக்கு பொருந்தாது. அத்தகைய நிலைமைகள் அதன் உணர்தலுக்கு அவசியம்:
- வாயுவின் செயற்கை அயனியாக்கம் இல்லாமல், உயர் மின்னழுத்தம் அல்லது உயர் மின்னோட்டம் உதவாது.
- வாயு நிலையில் உள்ள ஆக்ஸிஜன் இல்லாத அமிலங்கள் மற்றும் சில வாயுக்கள் மட்டுமே மின்னாற்பகுப்புக்கு ஏற்றவை.
முக்கியமான! தேவையான நிபந்தனைகள் பூர்த்தி செய்யப்பட்டால், செயல்முறை ஒரு திரவ எலக்ட்ரோலைட்டில் மின்னாற்பகுப்பைப் போலவே தொடர்கிறது.
கேத்தோடு மற்றும் அனோடில் நிகழும் செயல்முறைகளின் தனித்தன்மைகள்
மின்னாற்பகுப்பின் நடைமுறை பயன்பாட்டிற்கு, மின்சாரம் பயன்படுத்தப்படும் போது இரண்டு மின்முனைகளிலும் என்ன நடக்கிறது என்பதைப் புரிந்துகொள்வது அவசியம். பின்வரும் செயல்முறைகள் சிறப்பியல்பு:
- கத்தோட். நேர்மறை மின்னூட்டம் கொண்ட அயனிகள் அதை நோக்கி விரைகின்றன. இங்குதான் உலோகங்களின் குறைப்பு அல்லது ஹைட்ரஜன் வெளியீடு ஏற்படுகிறது. உலோகங்களின் பல வகைகளை அவற்றின் கேடனிக் செயல்பாட்டின் படி வேறுபடுத்தி அறியலாம். Li, K, Ba, St, Ca, Na, Mg, Be, Al போன்ற உலோகங்கள் உருகிய உப்புகளிலிருந்து மட்டுமே நன்கு குறைக்கப்படுகின்றன. ஒரு தீர்வு பயன்படுத்தப்பட்டால், நீரின் மின்னாற்பகுப்பு காரணமாக ஹைட்ரஜன் வெளியிடப்படுகிறது. கரைசலில் குறைப்பு வழங்குவது சாத்தியம், ஆனால் கேஷன்களின் போதுமான செறிவுடன், பின்வரும் உலோகங்களில் - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Ag, Cu, Bi, Pt, Au, Hg க்கு செயல்முறை எளிதானது.
- ஆனோட். எதிர்மறையாக சார்ஜ் செய்யப்பட்ட அயனிகள் இந்த மின்முனையில் வருகின்றன. அவற்றை ஆக்சிஜனேற்றம் செய்து, அவை எலக்ட்ரான்களை உலோகத்திலிருந்து எடுத்துச் செல்கின்றன, இது அவற்றின் அனோடிக் கரைப்புக்கு வழிவகுக்கிறது, அதாவது அயனிகள் நேர்மறையாக சார்ஜ் செய்யப்பட்ட அயனிகளாக மாற்றப்படுகின்றன, அவை கேத்தோடு நோக்கி இயக்கப்படுகின்றன. அயனிகளும் அவற்றின் செயல்பாட்டின் படி பிரிக்கப்படுகின்றன. PO4, CO3, SO4, NO3, NO2, ClO4, F அயனிகள் மட்டுமே உருகுவதில் இருந்து வெளியேற்றப்படும். அக்வஸ் கரைசல்களில், அவை மின்னாற்பகுப்புக்கு உட்படுத்தப்படுவதில்லை, ஆனால் ஆக்ஸிஜனை வெளியிடும் நீர். OH, Cl, I, S, Br போன்ற அயனிகள் மிக எளிதாக வினைபுரிகின்றன.

மின்னாற்பகுப்பை வழங்கும் போது, எலக்ட்ரோடு பொருளின் ஆக்சிஜனேற்றத்தின் போக்கைக் கருத்தில் கொள்வது அவசியம். இந்த வகையில், செயலற்ற மற்றும் செயலில் உள்ள அனோட்கள் வேறுபடுகின்றன. செயலற்ற மின்முனைகள் கிராஃபைட், நிலக்கரி அல்லது பிளாட்டினத்தால் ஆனவை மற்றும் அயனிகளின் விநியோகத்தில் ஈடுபடவில்லை.
மின்னாற்பகுப்பு செயல்முறையை பாதிக்கும் காரணிகள்
மின்னாற்பகுப்பு செயல்முறை பின்வரும் காரணிகளைப் பொறுத்தது:
- எலக்ட்ரோலைட்டின் கலவை. பல்வேறு அசுத்தங்களால் குறிப்பிடத்தக்க செல்வாக்கு செலுத்தப்படுகிறது. அவை 3 வகைகளாகப் பிரிக்கப்படுகின்றன - கேஷன்ஸ், அனான்கள் மற்றும் ஆர்கானிக். பொருட்கள் அடிப்படை உலோகத்தை விட அதிகமாகவோ அல்லது குறைவாகவோ எதிர்மறையாக இருக்கலாம், இது செயல்பாட்டில் குறுக்கிடுகிறது. கரிம அசுத்தங்களில் அசுத்தங்கள் (எ.கா. எண்ணெய்கள்) மற்றும் சர்பாக்டான்ட்கள் உள்ளன. அவற்றின் செறிவு வரம்பு மதிப்புகளைக் கொண்டுள்ளது.
- தற்போதைய அடர்த்தி. ஃபாரடேயின் சட்டங்களின்படி, தற்போதைய வலிமை அதிகரிக்கும் போது டெபாசிட் செய்யப்பட்ட பொருளின் நிறை அதிகரிக்கிறது. இருப்பினும், சாதகமற்ற சூழ்நிலைகள் எழுகின்றன - செறிவூட்டப்பட்ட துருவமுனைப்பு, அதிகரித்த மின்னழுத்தம், எலக்ட்ரோலைட்டின் தீவிர வெப்பம். இதைக் கருத்தில் கொண்டு, ஒவ்வொரு வழக்கிற்கும் தற்போதைய அடர்த்தியின் உகந்த மதிப்புகள் உள்ளன.
- எலக்ட்ரோலைட்டின் pH. நடுத்தரத்தின் அமிலத்தன்மையும் உலோகங்களை மனதில் கொண்டு தேர்ந்தெடுக்கப்படுகிறது. எடுத்துக்காட்டாக, துத்தநாகத்திற்கான எலக்ட்ரோலைட்டின் அமிலத்தன்மையின் உகந்த மதிப்பு 140 கிராம்/சிசி ஆகும்.
- எலக்ட்ரோலைட் வெப்பநிலை. இது ஒரு தெளிவற்ற விளைவைக் கொண்டுள்ளது. வெப்பநிலை அதிகரிக்கும் போது, மின்னாற்பகுப்பு விகிதம் அதிகரிக்கிறது, ஆனால் அசுத்தங்களின் செயல்பாடும் அதிகரிக்கிறது. ஒவ்வொரு செயல்முறைக்கும் உகந்த வெப்பநிலை உள்ளது. இது பொதுவாக 38-45 டிகிரிக்கு இடையில் இருக்கும்.
முக்கியமான! மின்னாற்பகுப்பு பல்வேறு தாக்கங்கள் மற்றும் எலக்ட்ரோலைட் கலவையின் தேர்வு மூலம் முடுக்கிவிடப்படலாம் அல்லது குறைக்கப்படலாம். ஒவ்வொரு பயன்பாட்டிற்கும் அதன் சொந்த பயன்முறை உள்ளது, இது கண்டிப்பாக கவனிக்கப்பட வேண்டும்.
மின்னாற்பகுப்பு எங்கே பயன்படுத்தப்படுகிறது?
மின்னாற்பகுப்பு பல பயன்பாடுகளில் பயன்படுத்தப்படுகிறது. நடைமுறை முடிவுகளுக்கு பல முக்கிய பயன்பாடுகளை அடையாளம் காணலாம்.
மின்முலாம் பூசுதல்
உலோகத்தின் மெல்லிய, நீடித்த கால்வனிக் பூச்சு மின்னாற்பகுப்பு மூலம் பயன்படுத்தப்படலாம்.பூசப்பட வேண்டிய பொருள் ஒரு கேத்தோடாக ஒரு குளியல் வைக்கப்படுகிறது, மேலும் எலக்ட்ரோலைட்டில் விரும்பிய உலோகத்தின் உப்பு உள்ளது. எஃகு துத்தநாகம், குரோமியம் அல்லது தகரத்தால் பூசப்படலாம்.

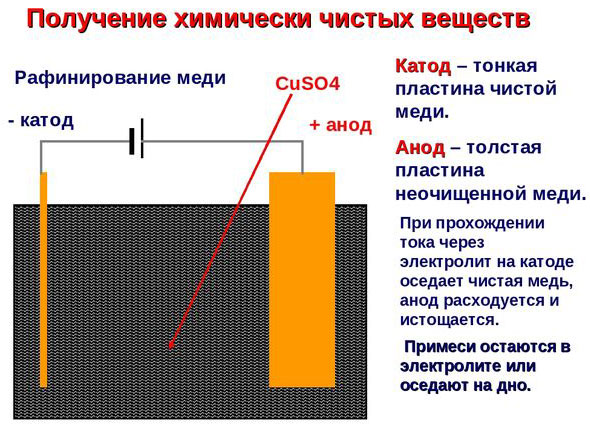
மின் சிகிச்சை - செம்பு சுத்திகரிப்பு
மின்சார சுத்திகரிப்புக்கான எடுத்துக்காட்டு இந்த விருப்பம்: கத்தோட் - தூய செம்பு, நேர்மின்முனை - அசுத்தங்கள் கொண்ட தாமிரம், எலக்ட்ரோலைட் - செப்பு சல்பேட்டின் நீர் தீர்வு. அனோடில் இருந்து தாமிரம் அயனிகளாக மாறுகிறது மற்றும் அசுத்தங்கள் இல்லாமல் கேத்தோடில் டெபாசிட் செய்யப்படுகிறது.
உலோக பிரித்தெடுத்தல்.
உப்புகளிலிருந்து உலோகங்களைப் பெற, அவை உருகுவதற்கு மாற்றப்படுகின்றன, பின்னர் அதில் மின்னாற்பகுப்பு வழங்கப்படுகிறது. பாக்சைட், சோடியம் மற்றும் பொட்டாசியம் ஆகியவற்றிலிருந்து அலுமினியத்தைப் பெறுவதற்கு இந்த முறை மிகவும் பயனுள்ளதாக இருக்கும்.

அனோடைசிங்
இந்த செயல்பாட்டில், பூச்சு உலோகம் அல்லாத கலவைகளிலிருந்து தயாரிக்கப்படுகிறது. சிறந்த உதாரணம் அலுமினியம் அனோடைசிங் ஆகும். அலுமினியம் பகுதி ஒரு நேர்மின்முனையைப் போல பொருத்தப்பட்டுள்ளது. எலக்ட்ரோலைட் என்பது சல்பூரிக் அமிலத்தின் ஒரு தீர்வு. மின்னாற்பகுப்பின் விளைவாக, அலுமினிய ஆக்சைட்டின் ஒரு அடுக்கு அனோடில் டெபாசிட் செய்யப்படுகிறது, இது பாதுகாப்பு மற்றும் அலங்கார பண்புகளைக் கொண்டுள்ளது. இந்த தொழில்நுட்பங்கள் பல்வேறு தொழில்களில் பரவலாகப் பயன்படுத்தப்படுகின்றன. உங்கள் சொந்த கைகளால் செயல்முறைகளை பாதுகாப்பான முறையில் மேற்கொள்ளவும் முடியும்.
ஆற்றல் செலவுகள்
மின்னாற்பகுப்புக்கு அதிக ஆற்றல் தேவைப்படுகிறது. அனோடிக் மின்னோட்டம் போதுமானதாக இருந்தால் இந்த செயல்முறை நடைமுறை மதிப்புடையதாக இருக்கும், இதற்காக மின்சார சக்தி மூலத்திலிருந்து கணிசமான நேரடி மின்னோட்டத்தைப் பயன்படுத்துவது அவசியம். கூடுதலாக, இது பக்க மின்னழுத்த இழப்புகளை உருவாக்குகிறது - அனோடிக் மற்றும் கத்தோடிக் ஓவர்வோல்டேஜ், அதன் எதிர்ப்பின் காரணமாக எலக்ட்ரோலைட்டில் இழப்புகள். ஆலையின் செயல்திறன் ஆற்றல் உள்ளீட்டின் சக்தியை பெறப்பட்ட பொருளின் பயனுள்ள வெகுஜனத்தின் அலகுடன் தொடர்புபடுத்துவதன் மூலம் தீர்மானிக்கப்படுகிறது.
மின்னாற்பகுப்பு நீண்ட காலமாக தொழில்துறையில் அதிக செயல்திறனுடன் பயன்படுத்தப்படுகிறது. அனோடைசிங் மற்றும் எலக்ட்ரோபிளேட்டிங் ஆகியவை அன்றாட வாழ்வில் பொதுவானதாகிவிட்டன, மேலும் சுரங்கம் மற்றும் பொருட்களின் நன்மைகள் தாதுவிலிருந்து பல உலோகங்களைப் பிரித்தெடுக்க உதவுகிறது.செயல்முறை திட்டமிடப்பட்டு அதன் அடிப்படை வடிவங்களை அறிந்து கணக்கிடலாம்.
தொடர்புடைய கட்டுரைகள்: