Det är ofta ett problem att avgöra vilken elektrod som är katod och vilken som är anod. En bra början är att definiera termerna.
Innehåll
Begreppet katod och anod - en enkel förklaring
I komplexa ämnen är elektronerna mellan atomerna i föreningarna inte jämnt fördelade. Växelverkan leder till att partiklar flyttas från en atom av ett ämne till en atom av ett annat ämne. Reaktionen kallas en oxidations-reduktionsreaktion. Förlusten av elektroner kallas oxidation, och det ämne som avger elektronerna kallas reduktionsmedel.
Tillägget av elektroner kallas reduktion, och det element som tar emot elektronerna kallas oxidationsmedel. Överföringen av elektroner från reduktionsmedlet till oxidationsmedlet kan ske genom en extern krets och kan sedan användas som en källa till elektrisk energi. Enheter som omvandlar energin från en kemisk reaktion till elektrisk energi kallas galvaniska celler.
Det enklaste klassiska exemplet på en galvanisk cell är två plattor av olika metaller som är nedsänkta i en elektrolytlösning. I detta system sker oxidation på den ena metallen och reduktion på den andra.
VIKTIGT! Den elektrod där oxidationen sker kallas anod. Den elektrod där reduktionen sker kallas katod.
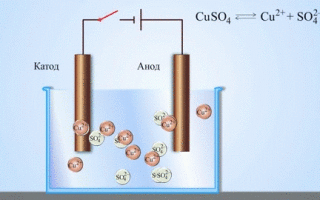
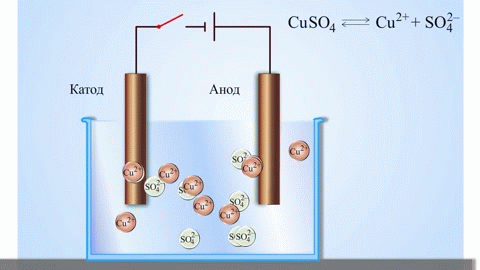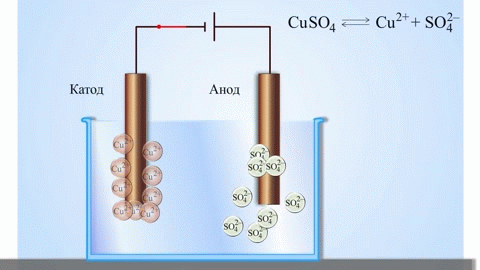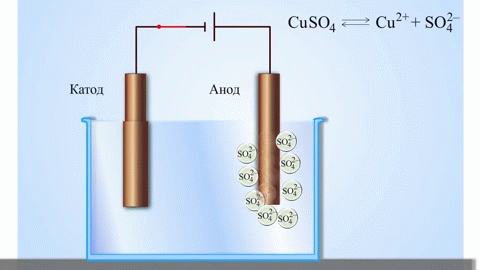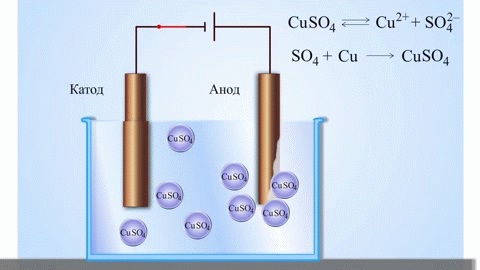
En galvanisk koppar-zinkcell, som fungerar genom att absorbera energin från reaktionen mellan zink och kopparsulfat, är ett välkänt exempel från skolans kemiläroböcker. I Jacoby-Daniel-anordningen placeras en kopparplatta i en kopparsulfatlösning (kopparelektrod) och en zinkplatta i en zinksulfatlösning (zinkelektrod). Zinkelektroden avger katjoner till lösningen, vilket skapar ett överskott av positiv laddning i den, medan lösningen vid kopparelektroden saknar katjoner, vilket gör att lösningen är negativt laddad.
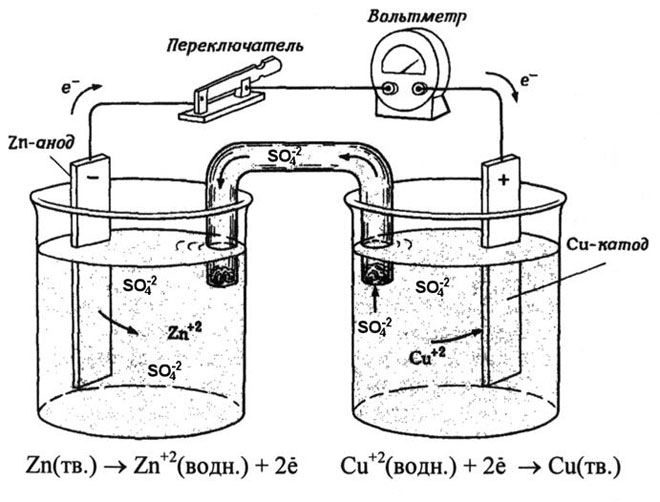
När den externa kretsen stängs, strömmar elektronerna från zinkelektroden till kopparelektroden. Jämviktsförhållandena vid fasgränserna avbryts. En redoxreaktion äger rum.
Energin från den spontana kemiska reaktionen omvandlas till elektrisk energi.
Om den kemiska reaktionen framkallas av extern elektrisk energi uppstår en process som kallas elektrolys. De processer som sker vid elektrolys är omvända jämfört med de processer som sker vid galvanisk celldrift.
UPPMÄRKSAMHET! Den elektrod på vilken reduktionen sker kallas också katod, men vid elektrolys är den negativt laddad och anoden positivt laddad.
Elektrokemiska tillämpningar
Anoder och katoder deltar i många kemiska reaktioner:
- Elektrolys;
- Elektroextraktion;
- Galvanisering;
- Galvanisering.
Elektrolys av smälta föreningar och vattenlösningar producerar metaller, renar metaller från föroreningar och extraherar värdefulla komponenter (elektrolytisk raffinering). Plattor gjuts av den metall som ska förädlas. Plattorna placeras som anoder i elektrolyseraren. Metallen löses upp av en elektrisk ström. Dess katjoner passerar in i lösningen och avges vid katoden, varvid en utfällning av ren metall bildas. De föroreningar som finns i den ursprungliga råmetallplattan förblir antingen olösliga som anodslam eller går över till elektrolyten där de avlägsnas. Koppar, nickel, bly, guld, silver och tenn raffineras elektrolytiskt.
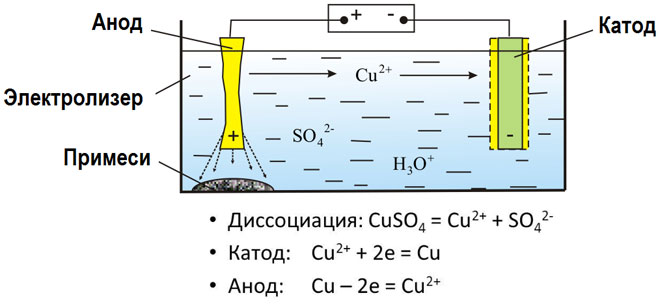
Elektroextraktion är processen för att extrahera metall från en lösning under elektrolys. För att överföra metallen till en lösning behandlas den med särskilda reagenser. Processen separerar metall med hög renhet vid katoden. Det är på detta sätt som zink, koppar och kadmium framställs.
För att undvika korrosion, göra produkten starkare och mer dekorativ, beläggs ytan av en metall med en annan. Denna process kallas elektroplätering.

Elektroformning är en process för att göra metallkopior av tredimensionella föremål genom elektrodeponering av metall.

Tillämpningar för vakuumelektronik
Principen för katod och anod i en vakuumapparat kan demonstreras med hjälp av ett elektronrör. Det ser ut som ett hermetiskt förseglat kärl med metalldelar inuti. Apparaten används för att likrikta, generera och omvandla elektriska signaler. Man skiljer på antalet elektroder:
- dioder;
- trioder;
- tetroder;
- pentoder etc.
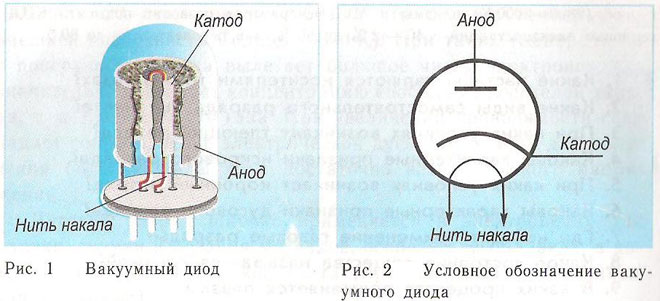
En diod är en vakuumanordning med två elektroder, en katod och en anod. Katoden är ansluten till strömförsörjningens negativa pol och anoden till den positiva polen. Syftet med katoden är att avge elektroner när den värms upp av en elektrisk ström till en viss temperatur. Elektronerna används för att skapa en rymdladdning mellan katoden och anoden. De snabbaste elektronerna rusar mot anoden och passerar den negativa potentialbarriären för rymdladdningen. Anoden tar emot partiklarna. Anodisk ström skapas i den externa kretsen. Elektronflödet styrs med hjälp av ytterligare elektroder som förses med en elektrisk potential. Dioderna används för att omvandla växelströmmen till likström.
Elektroniska tillämpningar
Idag används halvledartyper av dioder.
Diodernas egenskap att släppa igenom ström i framåtriktad riktning och att inte släppa igenom ström i bakåtriktad riktning används i stor utsträckning inom elektroniken.
En lysdiod bygger på egenskapen hos halvledarkristaller att lysa när en ström passerar genom p-n-övergången i framåtriktad riktning.
Galvaniska likströmskällor - batterier
Kemiska källor till elektrisk ström där reversibla reaktioner äger rum kallas uppladdningsbara batterier: de kan laddas upp och användas upprepade gånger.

När ett blybatteri fungerar sker en redoxreaktion. Metallblyet oxideras och avger sina elektroner, vilket minskar blydioxiden som tar upp elektronerna. Metallblyet i batteriet är anoden och är negativt laddat. Blydioxiden är katoden och är positivt laddad.
När batteriet laddas ur förbrukas ämnena i katoden och anoden och deras elektrolyt, svavelsyra. För att ladda batteriet ansluts det till en strömkälla (plus till plus, minus till minus). Strömmens riktning är nu motsatt den som rådde när batteriet laddades ur. De elektrokemiska processerna vid elektroderna är "omvända". Blyelektroden blir nu katod, där reduktionsprocessen äger rum, och blydioxiden blir anod, där oxidationsprocessen äger rum. De ämnen som behövs för batteriet skapas på nytt i batteriet.
Varför råder det förvirring?
Problemet uppstår eftersom ett visst laddningstecken inte kan fästas fast vid vare sig anoden eller katoden. Ofta är katoden den positivt laddade elektroden och anoden den negativa elektroden. Ofta, men inte alltid. Allt beror på den process som äger rum vid elektroden.
VARNING! En del som har placerats i elektrolyten kan vara både anod och katod. Allt beror på syftet med processen: att lägga på ett nytt metallskikt eller att ta bort ett metallskikt.
Hur man identifierar anod och katod
I elektrokemi är anoden den elektrod där oxidationsprocesser äger rum och katoden den elektrod där reduktion äger rum.
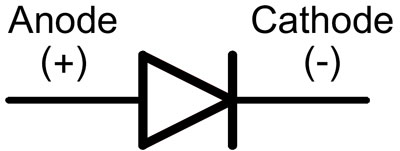
I en diod kallas ledningarna för anod och katod. Strömmen kommer att flöda genom dioden om anodledaren är ansluten till plus och katodledaren till minus.
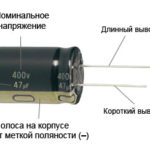
För en ny lysdiod med oklippta stift bestäms anoden och katoden visuellt av längden. Katoden är kortare.

Om kontakterna är avklippta hjälper ett batteri som är kopplat till dem. Ljuset kommer att synas när polariteterna stämmer överens.
Tecknet på anoden och katoden
Inom elektrokemin är det mer korrekt att tala om de processer som pågår på elektroderna än om elektrodernas tecken. Reduktionsreaktionen sker på katoden och oxidationsreaktionen på anoden.
Inom elektrotekniken är katoden ansluten till strömkällans negativa pol och anoden till den positiva polen.
Relaterade artiklar: