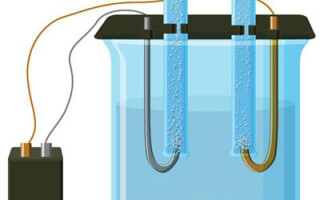
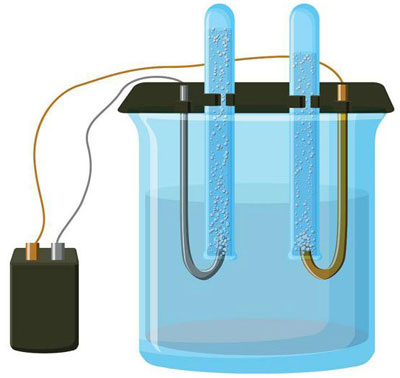
A questão do que é a electrólise tem sido discutida desde o curso de física escolar e não é segredo para a maioria das pessoas. Outra coisa é a sua importância e aplicação prática. Este processo é utilizado com grande vantagem em várias indústrias e pode vir a ser útil para o faz-tudo doméstico.
Conteúdos
- 1 O que é a electrólise?
- 2 As leis da electrólise de Faraday
- 3 Electrólise de fundições
- 4 Características da electrólise em soluções
- 5 Electrólise em gases
- 6 Características dos processos que ocorrem no cátodo e no ânodo
- 7 Factores que afectam o processo de electrólise
- 8 Onde é aplicada a electrólise?
- 9 Custos energéticos
O que é a electrólise?
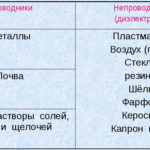
A electrólise é um complexo de processos específicos num sistema de eléctrodos e electrólitos com uma corrente eléctrica constante a fluir através dele. O seu mecanismo baseia-se na geração de uma corrente iónica. O electrólito é um condutor de tipo 2 (condutividade iónica) em que ocorre a dissociação electrolítica. Isto envolve a decomposição em iões com positivo (cation) e negativo (anião) taxa.
Um sistema de electrólise contém necessariamente um sistema positivo (ânodo) e um negativo (cathode) eléctrodo. Quando uma corrente eléctrica directa é aplicada, os cátions movem-se em direcção ao cátodo e os ânions movem-se em direcção ao ânodo. Os cátions são principalmente iões metálicos e hidrogénio, enquanto que os aniões são oxigénio e cloro. No cátodo, os cátions ganham excesso de electrões, permitindo assim a reacção de redução Men+ + ne → Me (onde n é a valência do metal). No ânodo, pelo contrário, os electrões são devolvidos do ânion, com a reacção de oxidação a ter lugar.
Assim, o processo redox é assegurado no sistema. O que é importante, contudo, é que o processo requer energia. Isto deve ser fornecido por uma fonte de corrente externa.
As leis da electrólise de Faraday
O grande físico M. Faraday não só tornou possível com a sua investigação compreender a natureza da electrólise, mas também fazer os cálculos necessários para a sua implementação. Em 1832 apareceram as suas leis, que ligavam os principais parâmetros dos processos em curso.
A primeira lei
A primeira lei de Faraday afirma que a massa de uma substância reduzida no ânodo é directamente proporcional à carga eléctrica induzida no electrólito: m = kq = k*I*t, onde q é a carga, k é o coeficiente ou equivalente electroquímico da substância, I é a corrente que flui através do electrólito e t é o tempo do fluxo de corrente.

Segunda lei
A segunda lei de Faraday tornou possível determinar o coeficiente de proporcionalidade k. A leitura é a seguinte: o equivalente electroquímico de qualquer substância é directamente proporcional à sua massa molar e inversamente proporcional à sua valência. A lei é expressa na forma:

k = 1/F*A/zonde F é a constante de Faraday, A é a massa molar da substância, z é a sua valência química.
Tendo em conta ambas as leis, a fórmula final para calcular a massa da substância depositada sobre o eléctrodo pode ser derivada: m = A*I*t/(n*F)onde n é o número de electrões envolvidos na electrólise. Normalmente n corresponde à carga do ião. De um ponto de vista prático, é importante relacionar a massa da substância com a corrente aplicada, o que permite que o processo seja controlado através da variação da sua força.
Electrólise de fundições
Uma variação da electrólise é a utilização de um derretimento como electrólito. Neste caso, apenas os iões de fusão estão envolvidos no processo electrolítico. Um exemplo clássico é a electrólise do sal derretido NaCl (sal de mesa). Os iões negativos precipitam-se para o ânodo, o que significa que o gás é libertado (Cl). No cátodo, haverá uma redução do metal, ou seja, o assentamento de Na puro, formado a partir dos iões positivos, que têm atraído o excesso de electrões. Outros metais podem ser produzidos de forma semelhante (K, Ca, Li, etc.) a partir da dissolução dos respectivos sais.
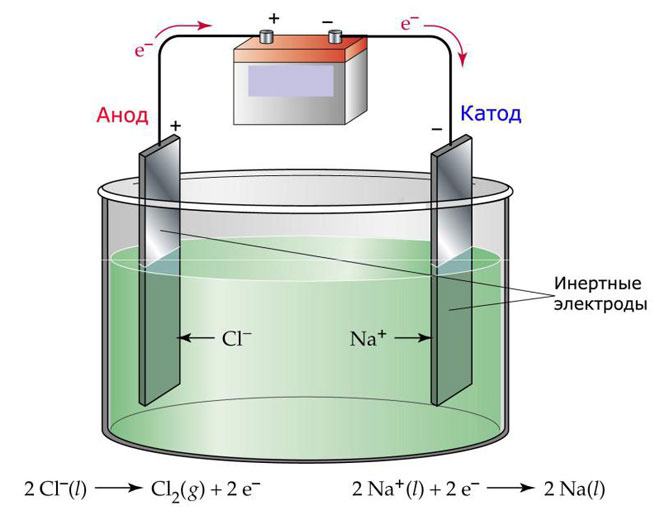
Na electrólise fundida, os eléctrodos não sofrem dissolução, mas apenas participam como uma fonte de corrente. O metal, grafite e alguns semicondutores podem ser utilizados no seu fabrico. É importante que o material tenha condutividade suficiente. Um dos materiais mais comuns é o cobre.
Características da electrólise em soluções
A electrólise numa solução aquosa é bastante diferente da electrólise por fusão. Aqui existem 3 processos concorrentes: oxidação da água que liberta oxigénio, oxidação do ânion e dissolução anódica do metal. O processo envolve iões de água, o electrólito e o ânodo. Consequentemente, a redução de hidrogénio, catiões electrólitos e ânodo metálico pode ter lugar no cátodo.

A capacidade de ocorrência destes processos concorrentes depende do potencial eléctrico do sistema. Apenas o processo que requer menos energia externa terá lugar. Consequentemente, os cátions com maior potencial de eléctrodo serão reduzidos no cátodo, e os ânions com menor potencial serão oxidados no ânodo. O potencial do eléctrodo de hidrogénio é tomado como "0". Por exemplo, em potássio é igual a (-2,93 В), o sódio é (-2,71 В), chumbo (-0,13 В), e para a prata é (+0,8 В).
Electrólise em gases
O gás só pode actuar como um electrólito se estiver presente um ionizador. Neste caso, a corrente flui através do meio ionizado, causando o processo necessário nos eléctrodos. As leis de Faraday não se aplicam à electrólise de gás. Tais condições são necessárias para a sua realização:
- Nem a alta tensão nem a alta corrente podem ajudar sem a ionização artificial do gás.
- Apenas ácidos gasosos sem oxigénio e certos gases são adequados para electrólise.
Importante! O processo procederá de forma semelhante à electrólise de um electrólito líquido se as condições necessárias forem preenchidas.
Características dos processos que decorrem no cátodo e no ânodo
Para a aplicação prática da electrólise, é importante compreender o que acontece em ambos os eléctrodos quando é aplicada uma corrente eléctrica. Os seguintes processos são característicos:
- Catódico. Os iões de carga positiva apressam-se em direcção a ela. É aqui que ocorre a redução de metais ou a libertação de hidrogénio. Várias categorias de metais podem ser distinguidas de acordo com a sua actividade catiónica. Metais tais como Li, K, Ba, St, Ca, Na, Mg, Be, Al são apenas bem reduzidos de sais fundidos. Se for utilizada uma solução, o hidrogénio é libertado através de electrólise da água. Os seguintes metais podem ser recuperados em solução, mas com uma concentração suficiente de cátions - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. O processo é mais fácil para Ag, Cu, Bi, Pt, Au, Hg.
- Ânodo. Os iões com carga negativa são alimentados com este eléctrodo. Ao oxidarem, retiram os electrões do metal, o que leva à sua dissolução anódica, ou seja Os ânions são convertidos em iões de carga positiva, que são direccionados para o cátodo. Os ânions são também subdivididos de acordo com a sua actividade. Apenas os ânions PO4, CO3, SO4, NO3, NO2, ClO4, F podem ser descarregados dos derretimentos. Em soluções aquosas, não são sujeitas a electrólise, mas sim a água com libertação de oxigénio. Aniões como OH, Cl, I, S e Br são os mais facilmente reagidos.

Ao fornecer a electrólise, é importante considerar a tendência do material do eléctrodo para oxidar. É feita uma distinção entre ânodos inertes e activos. Os eléctrodos inertes são feitos de grafite, carbono ou platina e não estão envolvidos no fornecimento de iões.
Factores que afectam o processo de electrólise
O processo de electrólise depende dos seguintes factores
- A composição do electrólito. Uma influência significativa é exercida pelas diferentes impurezas. Estes estão divididos em 3 tipos - catiões, ânions e orgânicos. As substâncias podem ser mais ou menos negativas do que o metal de base, e isto interfere com o processo. Entre as impurezas orgânicas existem poluentes (por exemplo, óleos) e tensioactivos. As suas concentrações estão nos valores máximos admissíveis.
- Densidade actual. De acordo com a lei de Faraday, a massa da substância depositada aumenta com a força da corrente. No entanto, surgem circunstâncias desfavoráveis - polarização concentrada, aumento da tensão, aquecimento intenso do electrólito. Com isto em mente, existem valores óptimos para a densidade actual em cada caso.
- pH electrolítico. A acidez do meio é também seleccionada tendo os metais em mente. Por exemplo, o pH óptimo para o zinco é de 140g/cc.
- Temperatura do electrólito. Isto tem um efeito ambíguo. À medida que a temperatura aumenta, a taxa de electrólise aumenta, mas também aumenta a actividade das impurezas. Há uma temperatura óptima para cada processo. Normalmente está entre 38 e 45 graus.
Importante! A electrólise pode ser acelerada ou desacelerada por diferentes influências e pela escolha da composição do electrólito. Para cada aplicação existe um regime diferente que deve ser estritamente respeitado.
Onde é utilizada a electrólise?
A electrólise é utilizada em muitas aplicações. Há vários usos principais que podem ser distinguidos para resultados práticos.
Galvanoplastia
Revestimentos metálicos finos e resistentes galvanizados podem ser aplicados por electrólise. O artigo revestido é colocado num banho como um cátodo e o electrólito contém um sal do metal desejado. É assim que se pode revestir aço com zinco, cromo ou estanho.

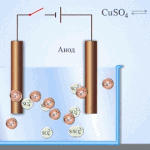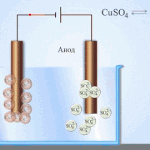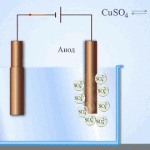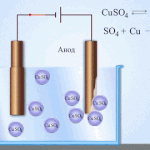
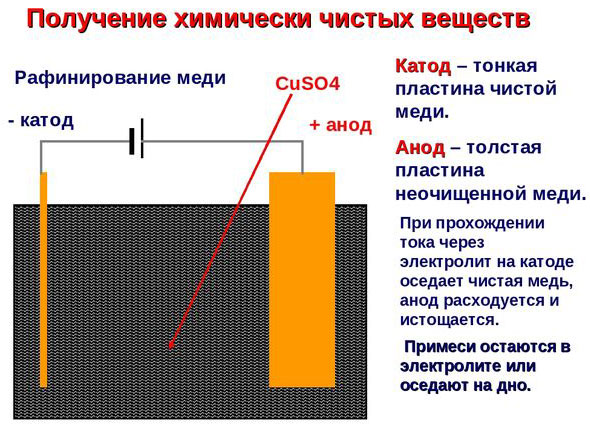
Electro refinação - refinação de cobre
Um exemplo de um processo de electrotratamento seria cathode - cobre puro ânodo - cobre com impurezas, electrólito - solução aquosa de sulfato de cobre. O cobre do ânodo converte-se em iões e é depositado no cátodo sem quaisquer impurezas.
Extracção de metais
Para extrair metais dos sais, os metais são fundidos e depois electrolisados na fusão. Este processo é bastante eficaz na recuperação do alumínio a partir da bauxite, sódio e potássio.

Anodização
Neste processo, o revestimento é feito de compostos não metálicos. O exemplo clássico é a anodização do alumínio. A parte de alumínio é montada como um ânodo. O electrólito é uma solução de ácido sulfúrico. Como resultado da electrólise, uma camada de óxido de alumínio é depositada sobre o ânodo, que tem propriedades protectoras e decorativas. As tecnologias acima referidas são amplamente utilizadas em diferentes indústrias. Também é possível realizar os processos com as suas próprias mãos e de uma forma segura.
Custos energéticos
A electrólise requer uma grande quantidade de energia. O processo será de valor prático se a corrente anódica for suficiente, o que requer uma corrente DC significativa a ser aplicada a partir da fonte de energia. Além disso, produz perdas de tensão lateral - sobretensões anódicas e catódicas, e perdas no electrólito devido à sua resistência. A eficiência de uma instalação é determinada pela relação entre a potência da energia consumida e a unidade de massa útil da substância obtida.
A electrólise tem sido utilizada há muito tempo na indústria com alta eficiência. A anodização e a galvanoplastia tornaram-se comuns na vida quotidiana, e a extracção e processamento de material ajuda a extrair muitos metais do minério. O processo pode ser planeado e calculado através do conhecimento dos seus padrões básicos.
Artigos relacionados: