É frequentemente um problema decidir que eléctrodo é o catódico e qual é o ânodo. Um bom começo é definir os termos.
O conceito de cátodo e ânodo - uma explicação simples
Em substâncias complexas, os electrões entre os átomos dos compostos não estão igualmente distribuídos. A interacção faz com que as partículas se movam de um átomo de uma substância para o átomo da outra. A reacção chama-se uma reacção de oxidação-redução. A perda de electrões chama-se oxidação, o elemento que desiste dos electrões chama-se agente redutor.
A adição de electrões chama-se redução, o elemento que assume os electrões chama-se oxidante. A transferência de electrões do agente redutor para o agente oxidante pode ter lugar através de um circuito externo, e depois pode ser utilizado como fonte de energia eléctrica. Os dispositivos que convertem a energia de uma reacção química em energia eléctrica são chamados células galvânicas.
O exemplo clássico mais simples de uma célula galvânica é duas placas feitas de metais diferentes e imersas numa solução electrolítica. Neste sistema, a oxidação ocorre num metal e a redução ocorre no outro.
IMPORTANTE! O eléctrodo onde a oxidação tem lugar chama-se ânodo. O eléctrodo onde a redução tem lugar chama-se o cátodo.
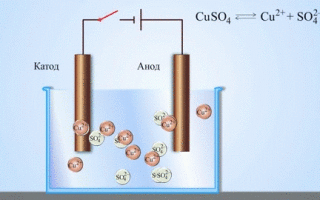
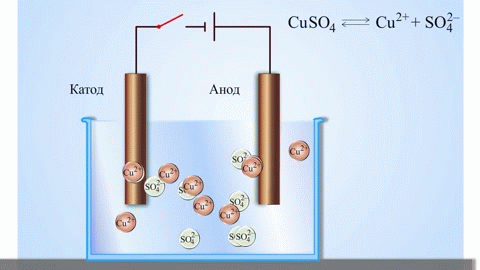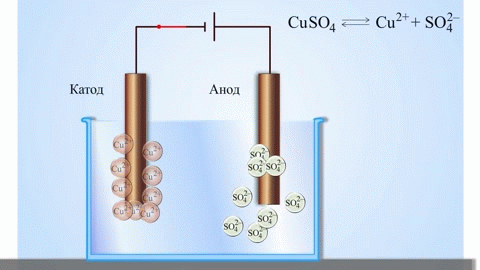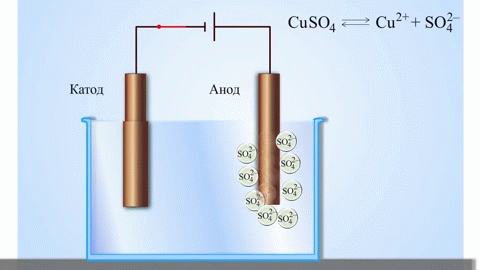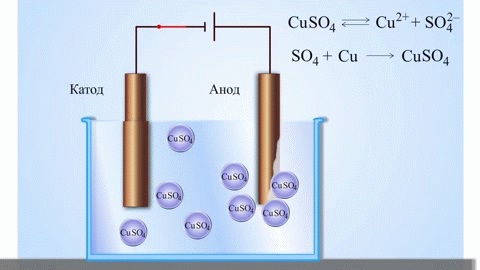
Uma célula galvânica cobre-zinco, que funciona através da absorção da energia da reacção entre o zinco e o sulfato de cobre, é um exemplo familiar dos manuais de química escolar. No dispositivo Jacoby-Daniel, uma placa de cobre é colocada numa solução de sulfato de cobre (eléctrodo de cobre) e uma placa de zinco é imersa numa solução de sulfato de zinco (eléctrodo de zinco). O eléctrodo de zinco liberta catiões na solução, criando um excesso de carga positiva na mesma, enquanto que no eléctrodo de cobre a solução se esgota de catiões, aqui a solução é carregada negativamente.
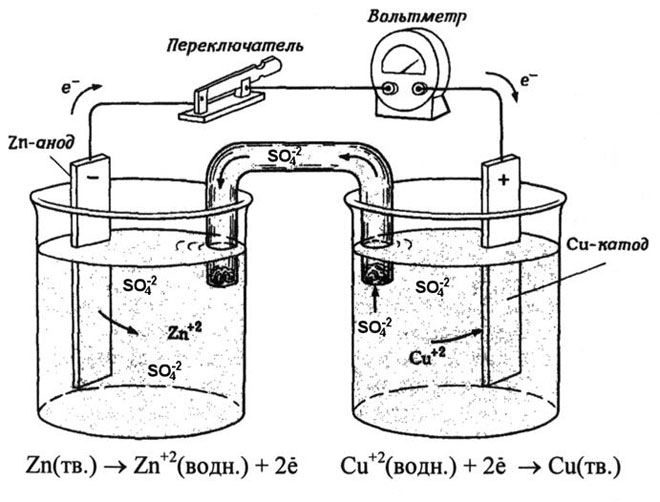
O fecho do circuito externo faz fluir os electrões do eléctrodo de zinco para o eléctrodo de cobre. As relações de equilíbrio nos limites de fase são interrompidas. Tem lugar uma reacção redox.
A energia da reacção química espontânea é convertida em energia eléctrica.
Se a reacção química for provocada por energia eléctrica externa, há um processo chamado electrólise. Os processos que ocorrem durante a electrólise são o inverso dos que ocorrem durante a operação com células galvânicas.
ATENÇÃO! O eléctrodo, sobre o qual a redução tem lugar, também é chamado de catódico, mas na electrólise é carregado negativamente e o ânodo é carregado positivamente.
Aplicações electroquímicas
Ânodos e cátodos tomam parte em muitas reacções químicas:
- Electrólise;
- Electro-extracção;
- Galvanoplastia;
- Galvanoplastia.
A electrólise de compostos fundidos e soluções aquosas produz metais, purifica metais de impurezas e extrai componentes valiosos (refinação electrolítica). As placas são fundidas a partir do metal a ser refinado. As placas são colocadas como ânodos no electrolisador. O metal é dissolvido por uma corrente eléctrica. Os seus cátions passam para a solução e são descarregados no cátodo, formando um precipitado de metal puro. As impurezas contidas na placa de metal bruto original ou permanecem insolúveis como lama anódica ou passam para o electrólito onde são removidas. Cobre, níquel, chumbo, ouro, prata e estanho são submetidos a uma refinação electrolítica.
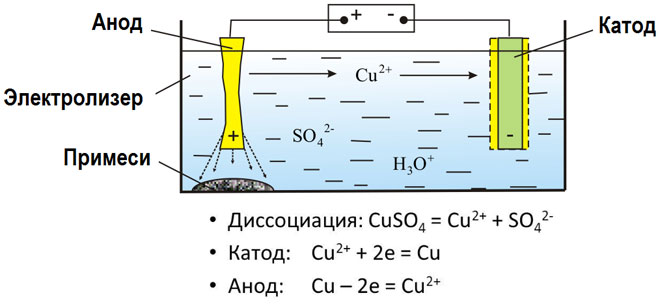
A electro-extracção é o processo de extracção de metal a partir de uma solução durante a electrólise. A fim de transferir o metal para a solução, é tratado com reagentes especiais. O processo separa o metal de alta pureza no cátodo. É assim que o zinco, o cobre e o cádmio são produzidos.
Para evitar a corrosão, tornar o produto mais forte e mais decorativo, a superfície de um metal é revestida com outro. Este processo é conhecido como galvanoplastia.

A electrodeposição é o processo de fazer cópias em metal de objectos tridimensionais por electrodeposição de metal.

Aplicações electrónicas a vácuo
O princípio do cátodo e do ânodo num aparelho de vácuo pode ser demonstrado por meio de um tubo de electrões. Parece um recipiente hermeticamente fechado com peças metálicas no seu interior. O dispositivo é utilizado para rectificar, gerar e converter sinais eléctricos. É feita uma distinção de acordo com o número de eléctrodos:
- diodos;
- tríodos;
- tetrodes;
- pentodes, etc.
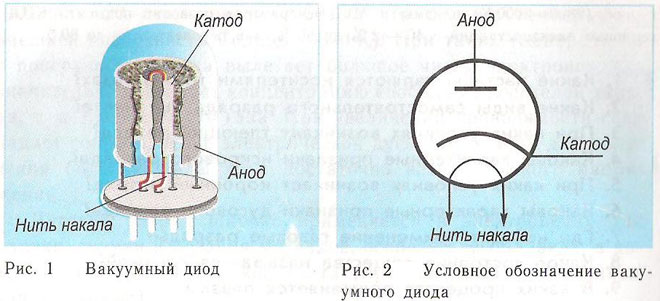
Um díodo é um dispositivo de vácuo com dois eléctrodos, um catódico e um ânodo. O cátodo está ligado ao pólo negativo da fonte de alimentação e o ânodo ao pólo positivo. O objectivo do cátodo é emitir electrões quando é aquecido por uma corrente eléctrica até uma certa temperatura. Os electrões são utilizados para criar uma carga espacial entre o cátodo e o ânodo. Os electrões mais rápidos correm em direcção ao ânodo, passando a barreira potencial negativa da carga espacial. O ânodo recebe as partículas. A corrente anódica é criada no circuito externo. O fluxo de electrões é controlado por meio de eléctrodos adicionais que são fornecidos com um potencial eléctrico. Os díodos são utilizados para converter a corrente alternada em corrente contínua.
Aplicações electrónicas
Hoje em dia, são utilizados tipos de díodos semicondutores.
A propriedade dos díodos para passar corrente na direcção da frente e não para passar corrente na direcção inversa é amplamente utilizada na electrónica.
O funcionamento de um LED baseia-se na propriedade dos cristais semicondutores de brilhar quando uma corrente é passada através da junção p-n na direcção da frente.
Fontes galvânicas de corrente contínua - baterias
As fontes químicas de corrente eléctrica em que ocorrem reacções reversíveis são chamadas baterias recarregáveis: são recarregadas e utilizadas repetidamente.

Quando uma bateria de chumbo-ácido funciona, tem lugar uma reacção redox. O chumbo metálico é oxidado e desiste dos seus electrões, reduzindo o dióxido de chumbo que absorve os electrões. O chumbo metálico na bateria é o ânodo e é carregado negativamente. O dióxido de chumbo é o catódico e é carregado positivamente.
À medida que a bateria descarrega, as substâncias do cátodo e ânodo e o seu electrólito, ácido sulfúrico, são consumidas. Para carregar a bateria, esta é ligada a uma fonte de corrente (mais para mais, menos para menos). A direcção da corrente é agora o oposto do que era quando a bateria foi descarregada. Os processos electroquímicos nos eléctrodos são "invertidos". O eléctrodo de chumbo torna-se agora o cátodo, com o processo de redução a ter lugar ali, e o dióxido de chumbo torna-se o ânodo, com o processo de oxidação a ter lugar. As substâncias necessárias para a bateria são novamente criadas na bateria.
Porque é que existe confusão?
O problema surge porque um determinado sinal de carga não pode estar firmemente ligado nem ao ânodo nem ao cátodo. Muitas vezes o cátodo é o eléctrodo com carga positiva e o ânodo é o eléctrodo negativo. Muitas vezes, mas nem sempre. Tudo depende do processo que tem lugar no eléctrodo.
ADVERTÊNCIA! Uma parte que foi colocada no electrólito pode ser tanto o ânodo como o cátodo. Depende do objectivo do processo: aplicar outra camada de metal ou remover uma camada de metal.
Como identificar o ânodo e o cátodo
Na electroquímica, o ânodo é o eléctrodo onde ocorrem os processos de oxidação, o cátodo é o eléctrodo onde ocorre a redução.
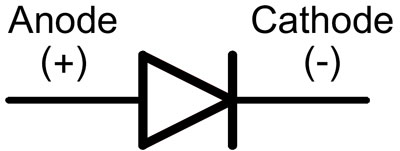
Num díodo, as pistas são chamadas de ânodo e cátodo. A corrente fluirá através do díodo se o anodo condutor estiver ligado ao 'mais' e o cátodo condutor ao 'menos'.
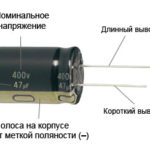
Para um novo LED com pinos não cortados, o ânodo e o cátodo são determinados visualmente pelo comprimento. O catódico é mais curto.

Se os contactos forem cortados, uma bateria ligada a eles ajudará. A luz aparecerá quando as polaridades coincidirem.
O sinal do ânodo e do cátodo
Em electroquímica, é mais correcto falar sobre os processos que decorrem nos eléctrodos do que sobre os sinais dos eléctrodos. A reacção de redução tem lugar no cátodo e a reacção de oxidação tem lugar no ânodo.
Na engenharia eléctrica, o cátodo está ligado ao pólo negativo da fonte de corrente e o ânodo ao pólo positivo.
Artigos relacionados: