De vraag wat elektrolyse is, wordt al sinds de natuurkundecursus op school besproken en is voor de meeste mensen geen geheim. Een ander punt is het belang en de praktische toepassing ervan. Dit proces wordt in diverse industrieën met groot voordeel toegepast en kan ook van pas komen voor de thuisklusser.
Inhoud
- 1 Wat is elektrolyse?
- 2 Faraday's wetten van elektrolyse
- 3 Elektrolyse van smelt
- 4 Eigenschappen van elektrolyse in oplossingen
- 5 Elektrolyse in gassen
- 6 Eigenschappen van de processen die zich aan de kathode en de anode voordoen
- 7 Factoren die het elektrolyseproces beïnvloeden
- 8 Waar wordt elektrolyse toegepast?
- 9 Energiekosten
Wat is elektrolyse?
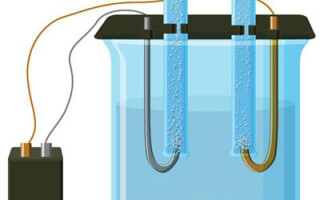
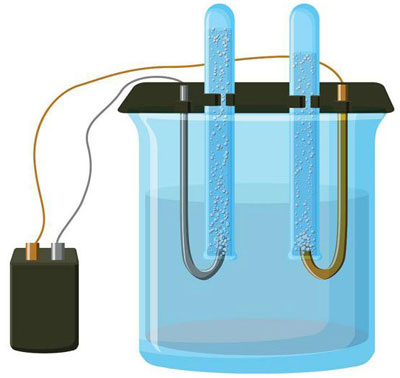
Elektrolyse is een complex van specifieke processen in een systeem van elektroden en elektrolyten met een constante elektrische stroom. Het mechanisme is gebaseerd op de opwekking van een ionische stroom. De elektrolyt is een geleider van type 2 (ionische geleidbaarheid) waarin elektrolytische dissociatie optreedt. Hierbij vindt ontleding plaats in ionen met positieve (catie) en negatief (anion) lading.
Een elektrolyse systeem bevat noodzakelijkerwijs een positieve (anode) en een negatieve (kathode) elektrode. Wanneer een gelijkstroom wordt aangelegd, bewegen de kationen zich naar de kathode en de anionen naar de anode. De kationen zijn hoofdzakelijk metaalionen en waterstof, terwijl de anionen zuurstof en chloor zijn. Aan de kathode hechten de kationen de overtollige elektronen, waardoor de reductiereactie Men+ + ne → Me (waarin n de valentie van het metaal is). Aan de anode daarentegen worden elektronen teruggegeven van het anion, waarbij de oxidatiereactie plaatsvindt.
Aldus wordt het redoxproces in het systeem gewaarborgd. Wat wel belangrijk is, is dat het proces energie vereist. Deze moet worden geleverd door een externe stroombron.
Faraday's wetten van elektrolyse
De grote natuurkundige M. Faraday maakte het met zijn onderzoek niet alleen mogelijk de aard van elektrolyse te begrijpen, maar ook de nodige berekeningen te maken om deze uit te voeren. In 1832 verschenen zijn wetten, die de belangrijkste parameters van de plaatsvindende processen met elkaar in verband brachten.
De eerste wet
De eerste wet van Faraday stelt dat de massa van een stof die aan de anode wordt gereduceerd recht evenredig is met de elektrische lading die in de elektrolyt wordt geïnduceerd: m = kq = k*I*t, waarbij q de lading is, k de coëfficiënt of het elektrochemische equivalent van de stof, I de stroom die door de elektrolyt loopt en t de tijd van de stroomafname.

Tweede wet
De tweede wet van Faraday maakte het mogelijk de evenredigheidscoëfficiënt k te bepalen. Deze luidt als volgt: het elektrochemisch equivalent van een stof is recht evenredig met zijn molaire massa en omgekeerd evenredig met zijn valentie. De wet wordt uitgedrukt in de vorm:

k = 1/F*A/zwaarin F de constante van Faraday is, A de molaire massa van de stof, z de chemische valentie.
Rekening houdend met beide wetten, kunnen wij de uiteindelijke formule afleiden voor de berekening van de massa van de stof die op de elektrode wordt afgezet: m = A*I*t/(n*F)waarbij n het aantal elektronen is dat bij de elektrolyse betrokken is. Gewoonlijk komt n overeen met de lading van het ion. Uit praktisch oogpunt is het van belang de massa van de stof te relateren aan de toegepaste stroom, waardoor het proces kan worden beheerst door de sterkte ervan te variëren.
Elektrolyse van smelt
Een variant van elektrolyse is het gebruik van een smelt als elektrolyt. In dit geval zijn alleen de smeltionen betrokken bij het elektrolytische proces. Een klassiek voorbeeld is de elektrolyse van de zoutsmelt NaCl (tafelzout). Negatieve ionen haasten zich naar de anode, wat betekent dat er gas vrijkomt (Cl). Aan de kathode vindt een reductie van het metaal plaats, d.w.z. de afzetting van zuiver Na, gevormd uit de positieve ionen, die overtollige elektronen hebben aangetrokken. Andere metalen kunnen op soortgelijke wijze worden geproduceerd (K, Ca, Li enz.) uit het oplossen van de respectieve zouten.
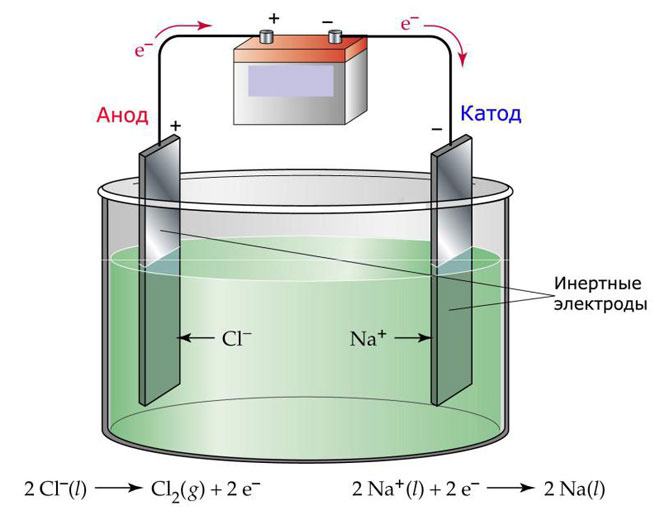
Bij gesmolten elektrolyse worden de elektroden niet opgelost, maar fungeren zij alleen als stroombron. Bij de vervaardiging ervan kunnen metaal, grafiet en sommige halfgeleiders worden gebruikt. Het is belangrijk dat het materiaal voldoende geleidingsvermogen heeft. Een van de meest voorkomende materialen is koper.
Eigenschappen van elektrolyse in oplossingen
Elektrolyse in een waterige oplossing is heel wat anders dan smeltelektrolyse. Hier zijn er 3 concurrerende processen: oxidatie van water waarbij zuurstof vrijkomt, oxidatie van het anion en anodische oplossing van het metaal. Bij het proces zijn waterionen, de elektrolyt en de anode betrokken. Bijgevolg kan de reductie van waterstof, elektrolytkationen en anodemetaal aan de kathode plaatsvinden.

Het vermogen van deze concurrerende processen om zich te voltrekken hangt af van de elektrische potentiaal van het systeem. Alleen het proces dat minder externe energie vereist, zal plaatsvinden. Daarom zullen de kationen met het hoogste elektrodepotentiaal aan de kathode worden gereduceerd en de anionen met het laagste potentiaal aan de anode worden geoxideerd. De elektrodepotentiaal van waterstof wordt op "0" gesteld. Bijvoorbeeld, in kalium is het gelijk aan (-2,93 В), natrium is (-2,71 В), lood (-0,13 В), en voor zilver is dat (+0,8 В).
Elektrolyse in gassen
Het gas kan alleen als elektrolyt werken als er een ionisator aanwezig is. In dit geval vloeit er stroom door het geïoniseerde medium, waardoor bij de elektroden het noodzakelijke proces op gang komt. De wetten van Faraday gelden niet voor gaselektrolyse. Dergelijke voorwaarden zijn noodzakelijk voor de verwezenlijking ervan:
- Noch hoge spanning, noch hoge stroom kunnen helpen zonder kunstmatige ionisatie van het gas.
- Alleen zuurstofvrije gasvormige zuren en bepaalde gassen zijn geschikt voor elektrolyse.
Belangrijk! Het proces verloopt op soortgelijke wijze als elektrolyse in een vloeibaar elektrolyt, indien aan de nodige voorwaarden is voldaan.
Eigenschappen van de processen die plaatsvinden aan de kathode en de anode
Voor de praktische toepassing van elektrolyse is het belangrijk te begrijpen wat er aan beide elektroden gebeurt wanneer een elektrische stroom wordt aangelegd. De volgende processen zijn kenmerkend:
- Kathode. De positief geladen ionen haasten zich erheen. Hier vindt de reductie van metalen of het vrijkomen van waterstof plaats. Op grond van hun kationische activiteit kunnen verschillende categorieën metalen worden onderscheiden. Metalen zoals Li, K, Ba, St, Ca, Na, Mg, Be, Al worden alleen goed gereduceerd uit gesmolten zouten. Als een oplossing wordt gebruikt, komt waterstof vrij door elektrolyse van water. De volgende metalen kunnen in oplossing worden teruggewonnen, maar met een voldoende kationenconcentratie - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Het proces is het gemakkelijkst voor Ag, Cu, Bi, Pt, Au, Hg.
- Anode. Negatief geladen ionen worden naar deze elektrode gevoerd. Bij de oxidatie onttrekken zij elektronen aan het metaal, wat leidt tot hun anodische ontbinding, d.w.z. De anionen worden omgezet in positief geladen ionen, die naar de kathode worden geleid. De anionen worden eveneens onderverdeeld volgens hun activiteit. Alleen de anionen PO4, CO3, SO4, NO3, NO2, ClO4, F kunnen uit de smelt worden afgevoerd. In waterige oplossingen worden zij niet aan elektrolyse onderworpen, maar aan water waarbij zuurstof vrijkomt. De anionen die het gemakkelijkst reageren zijn OH, Cl, I, S en Br.

Bij elektrolyse is het van belang rekening te houden met de neiging van het elektrodemateriaal om te oxideren. Er wordt een onderscheid gemaakt tussen inerte en actieve anoden. Inerte elektroden zijn gemaakt van grafiet, koolstof of platina en zijn niet betrokken bij de toevoer van ionen.
Factoren die het elektrolyseproces beïnvloeden
Het elektrolyseproces is afhankelijk van de volgende factoren
- De samenstelling van de elektrolyt. Een belangrijke invloed wordt uitgeoefend door de verschillende onzuiverheden. Deze worden onderverdeeld in 3 soorten - kationen, anionen en organische stoffen. De stoffen kunnen meer of minder negatief zijn dan het basismetaal, en dit belemmert het proces. Onder de organische onzuiverheden bevinden zich verontreinigende stoffen (b.v. oliën) en oppervlakte-actieve stoffen. Hun concentraties liggen op de maximaal toelaatbare waarden.
- Stroomdichtheid. Volgens de wet van Faraday neemt de massa van de afgezette stof toe met de sterkte van de stroom. Er doen zich echter ongunstige omstandigheden voor - geconcentreerde polarisatie, verhoogde spanning, sterke verhitting van de elektrolyt. Met dit in gedachten zijn er in elk geval optimale waarden voor de stroomdichtheid.
- pH van elektrolyt. De zuurtegraad van het medium wordt ook gekozen met metalen in gedachten. De optimale pH-waarde voor zink is bijvoorbeeld 140g/cc.
- Temperatuur van het elektrolyt. Dit heeft een dubbelzinnig effect. Naarmate de temperatuur stijgt, neemt de elektrolysesnelheid toe, maar ook de activiteit van de onzuiverheden. Er is een optimale temperatuur voor elk proces. Het is meestal tussen 38 en 45 graden.
Belangrijk! De elektrolyse kan worden versneld of vertraagd door verschillende invloeden en de keuze van de samenstelling van het elektrolyt. Voor elke toepassing is er een andere regeling die strikt moet worden nageleefd.
Waar wordt elektrolyse gebruikt?
Elektrolyse wordt in vele toepassingen gebruikt. Er zijn verschillende belangrijke toepassingen die kunnen worden onderscheiden voor praktische resultaten.
Galvanisch bekleden
Door elektrolyse kan een dunne, harde galvanische laag metaal worden aangebracht. Het gecoate voorwerp wordt als kathode in een bad geplaatst en de elektrolyt bevat een zout van het gewenste metaal. Zo kun je staal coaten met zink, chroom of tin.

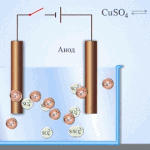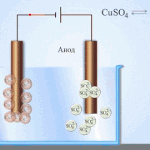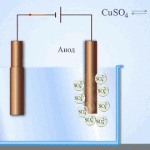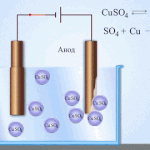
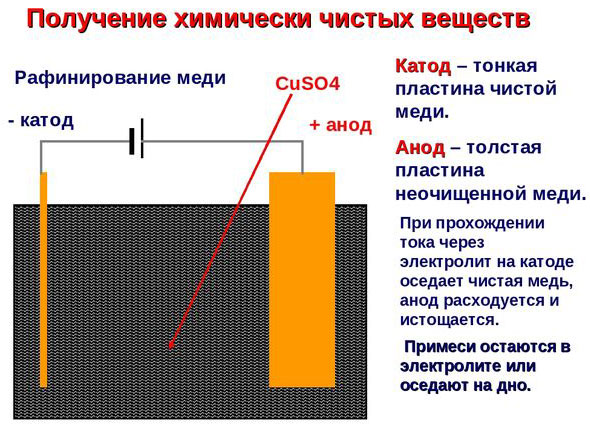
Elektroraffinage - raffinage van koper
Een voorbeeld van een elektrolytisch behandelingsproces zou zijn kathode - zuiver koper anode - koper met onzuiverheden, elektrolyt - waterige kopersulfaatoplossing. Het koper van de anode zet zich om in ionen en wordt zonder onzuiverheden afgezet in de kathode.
Metaal extractie
Om metalen uit zouten te extraheren, worden de metalen gesmolten en vervolgens in de smelt geëlektrolyseerd. Dit procédé is zeer doeltreffend voor de terugwinning van aluminium uit bauxiet, natrium en kalium.

Anodiseren
Bij dit procédé wordt de coating gemaakt van niet-metaalhoudende verbindingen. Het klassieke voorbeeld is de anodisatie van aluminium. Het aluminium deel is gemonteerd als een anode. De elektrolyt is een oplossing van zwavelzuur. Als gevolg van de elektrolyse wordt op de anode een laag aluminiumoxide afgezet, die beschermende en decoratieve eigenschappen heeft. Bovengenoemde technologieën worden op grote schaal gebruikt in verschillende industrieën. Het is ook mogelijk om de processen met uw eigen handen en op een veilige manier uit te voeren.
Energiekosten
Elektrolyse vergt veel energie. Het proces zal van praktische waarde zijn indien de anodestroom voldoende is, hetgeen vereist dat een aanzienlijke gelijkstroom wordt aangelegd vanuit de stroombron. Bovendien veroorzaakt het zijspanningsverliezen - anodische en kathodische overspanningen, en verliezen in de elektrolyt door zijn weerstand. Het rendement van een installatie wordt bepaald door het vermogen van de toegevoerde energie te relateren aan de eenheid van nuttige massa van de verkregen stof.
Elektrolyse wordt in de industrie reeds lang met hoge efficiëntie toegepast. Anodiseren en galvaniseren zijn gemeengoed geworden in het dagelijks leven, en materiaalwinning en -verwerking helpen om vele metalen uit erts te halen. Het proces kan worden gepland en berekend door de basispatronen ervan te kennen.
Verwante artikelen: