Het is vaak een probleem te bepalen welke elektrode de kathode en welke de anode is. Een goed begin is de termen te definiëren.
Het concept van kathode en anode - een eenvoudige uitleg
In complexe stoffen zijn de elektronen tussen de atomen in de verbindingen niet gelijk verdeeld. Door de wisselwerking bewegen de deeltjes van het ene atoom van de ene stof naar het atoom van de andere. De reactie wordt een oxidatiereductiereactie genoemd. Het verlies van elektronen wordt oxidatie genoemd, het element dat de elektronen afstaat wordt het reductiemiddel genoemd.
De toevoeging van elektronen wordt reductie genoemd, het element dat de elektronen opneemt wordt oxidator genoemd. De overdracht van elektronen van het reductiemiddel naar het oxidatiemiddel kan plaatsvinden via een externe stroomkring, en vervolgens worden gebruikt als bron van elektrische energie. Apparaten die de energie van een chemische reactie omzetten in elektrische energie worden galvanische cellen genoemd.
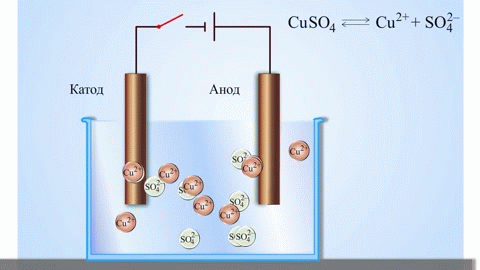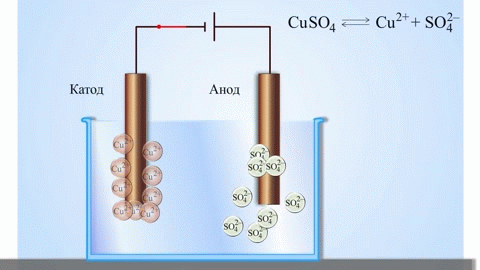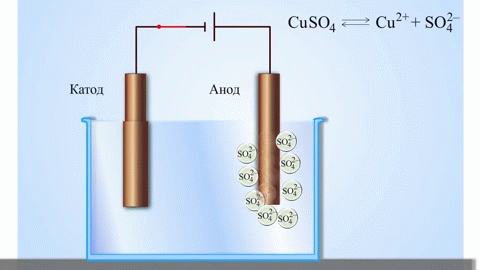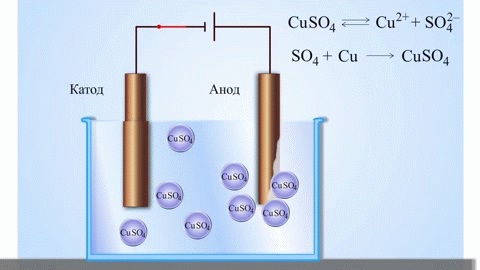
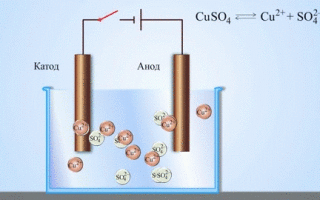
Het eenvoudigste klassieke voorbeeld van een galvanische cel zijn twee platen van verschillende metalen die in een elektrolytoplossing zijn ondergedompeld. In dit systeem vindt de oxidatie plaats op het ene metaal en de reductie op het andere.
BELANGRIJK! De elektrode waar de oxidatie plaatsvindt, wordt de anode genoemd. De elektrode waar de reductie plaatsvindt, wordt de kathode genoemd.
Een koper-zink galvanische cel, die werkt door de energie van de reactie tussen zink en kopersulfaat te absorberen, is een bekend voorbeeld uit scheikundeboeken op school. In het Jacoby-Danielapparaat wordt een koperen plaat in een kopersulfaatoplossing (koperelektrode) en een zinkplaat in een zinksulfaatoplossing (zinkelektrode) gedompeld. De zinkelektrode geeft kationen af aan de oplossing, waardoor er een overmaat aan positieve lading in de oplossing ontstaat, terwijl de oplossing bij de koperelektrode uitgeput is van kationen, hier is de oplossing negatief geladen.
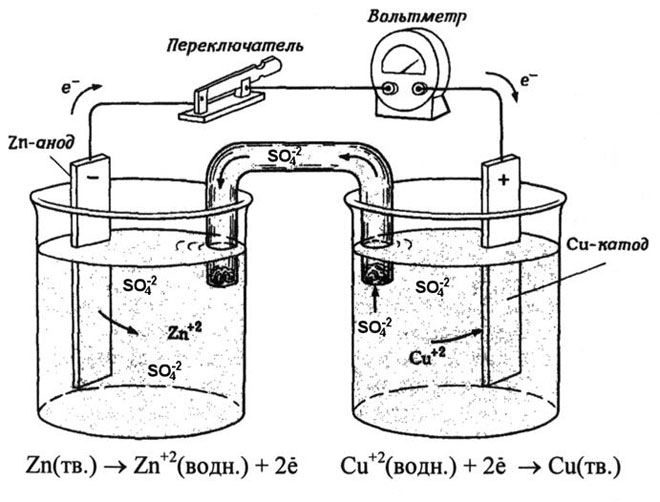
Het sluiten van de externe stroomkring veroorzaakt dat elektronen van de zinkelektrode naar de koperelektrode stromen. De evenwichtsrelaties aan de fasegrenzen worden onderbroken. De redox-reactie vindt plaats.
De energie van de spontane chemische reactie wordt omgezet in elektrische energie.
Indien de chemische reactie wordt uitgelokt door externe elektrische energie, is er een proces dat elektrolyse wordt genoemd. De processen die tijdens de elektrolyse optreden zijn omgekeerd aan die welke tijdens de werking van galvanische cellen optreden.
ATTENTIE! De elektrode, waarop de reductie plaatsvindt, wordt ook kathode genoemd, maar bij elektrolyse is deze negatief geladen en de anode positief geladen.
Elektrochemische toepassingen
Anoden en kathoden nemen deel aan vele chemische reacties:
- Elektrolyse;
- Elektro-extractie;
- Electroplating;
- Electroplating.
De elektrolyse van gesmolten verbindingen en waterige oplossingen produceert metalen, zuivert metalen van onzuiverheden en extraheert waardevolle bestanddelen (elektrolytische raffinage). Platen worden gegoten uit het metaal dat moet worden geraffineerd. De platen worden als anodes in de elektrolyser geplaatst. Het metaal wordt opgelost door een elektrische stroom. De kationen ervan gaan in de oplossing over en worden aan de kathode afgevoerd, waarbij een neerslag van zuiver metaal wordt gevormd. De onzuiverheden in de oorspronkelijke ruwe metaalplaat blijven ofwel onoplosbaar als anodeslib ofwel gaan over in de elektrolyt waar zij worden verwijderd. Koper, nikkel, lood, goud, zilver en tin worden elektrolytisch geraffineerd.
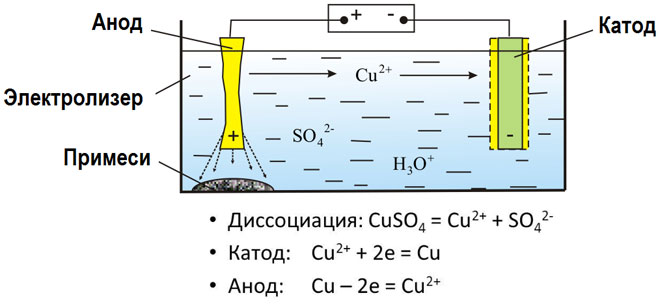
Elektro-extractie is het proces waarbij metaal uit een oplossing wordt geëxtraheerd door middel van elektrolyse. Om het metaal in oplossing te brengen, wordt het behandeld met speciale reagentia. Het proces scheidt hoogzuiver metaal af aan de kathode. Zo worden zink, koper en cadmium geproduceerd.
Om corrosie te voorkomen en het product sterker en decoratiever te maken, wordt het oppervlak van het ene metaal met het andere bekleed. Dit proces wordt galvaniseren genoemd.

Elektrovormen is het maken van metalen kopieën van driedimensionale voorwerpen door het elektroforceren van metaal.

Vacuüm elektronische toepassingen
Het principe van de kathode en de anode in een vacuümtoestel kan worden gedemonstreerd met behulp van een elektronenbuis. Het lijkt op een hermetisch afgesloten vat met metalen onderdelen erin. Het toestel wordt gebruikt om elektrische signalen gelijk te schakelen, op te wekken en om te zetten. Er wordt een onderscheid gemaakt naar gelang van het aantal elektroden:
- diodes;
- triodes;
- tetrodes;
- pentodes enz.
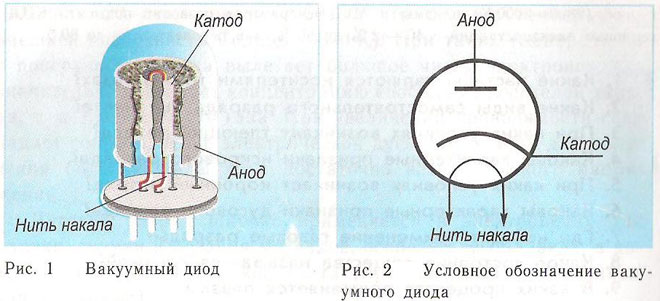
Een diode is een vacuümtoestel met twee elektroden, een kathode en een anode. De kathode is verbonden met de negatieve pool van de voeding en de anode met de positieve pool. Het doel van de kathode is elektronen uit te zenden wanneer deze door een elektrische stroom tot een bepaalde temperatuur wordt verhit. De elektronen worden gebruikt om een ruimtelading te creëren tussen de kathode en de anode. De snelste elektronen haasten zich naar de anode en passeren de negatieve potentiaalbarrière van de ruimtelading. De anode ontvangt de deeltjes. Er ontstaat anodestroom in het externe circuit. De elektronenstroom wordt geregeld door middel van extra elektroden die van een elektrisch potentiaal worden voorzien. De diodes worden gebruikt om de wisselstroom om te zetten in gelijkstroom.
Elektronicatoepassingen
Tegenwoordig worden halfgeleidertypes van diodes gebruikt.
De eigenschap van dioden om stroom in voorwaartse richting door te laten en geen stroom in achterwaartse richting door te laten, wordt veel gebruikt in de elektronica.
De werking van een LED is gebaseerd op de eigenschap van halfgeleiderkristallen om te gloeien wanneer een stroom in voorwaartse richting door de p-n junctie wordt geleid.
Galvanische bronnen van gelijkstroom - batterijen
Chemische bronnen van elektrische stroom waarin omkeerbare reacties plaatsvinden, worden oplaadbare batterijen genoemd: zij kunnen worden opgeladen en herhaaldelijk worden gebruikt.

Wanneer een loodzuur-batterij werkt, vindt er een redox-reactie plaats. Het metallisch lood wordt geoxideerd en geeft zijn elektronen af, waardoor het looddioxide, dat de elektronen opneemt, wordt gereduceerd. Het metalen lood in de batterij is de anode en is negatief geladen. Het looddioxide is de kathode en is positief geladen.
Tijdens de ontlading van de accu worden de stoffen van de kathode en de anode en hun elektrolyt, zwavelzuur, verbruikt. Om de batterij op te laden, wordt deze aangesloten op een stroombron (plus op plus, min op min). De richting van de stroom is nu tegengesteld aan die van toen de batterij werd ontladen. De elektrochemische processen aan de elektroden worden "omgekeerd". De loodelektrode wordt nu de kathode, waar het reductieproces plaatsvindt, en het looddioxide wordt de anode, waar het oxidatieproces plaatsvindt. De stoffen die nodig zijn voor de batterij worden weer aangemaakt in de batterij.
Waarom is er verwarring?
Het probleem ontstaat doordat een bepaald ladingteken noch aan de anode noch aan de kathode stevig kan worden bevestigd. Vaak is de kathode de positief geladen elektrode en de anode de negatief geladen elektrode. Vaak, maar niet altijd. Het hangt allemaal af van het proces dat plaatsvindt bij de elektrode.
WAARSCHUWING! Een onderdeel dat in de elektrolyt is geplaatst, kan zowel de anode als de kathode zijn. Het hangt allemaal af van het doel van het proces: een nieuwe laag metaal aanbrengen of een laag metaal verwijderen.
Hoe identificeer je de anode en de kathode?
In de elektrochemie is de anode de elektrode waar het oxidatieproces plaatsvindt, de kathode is de elektrode waar de reductie plaatsvindt.
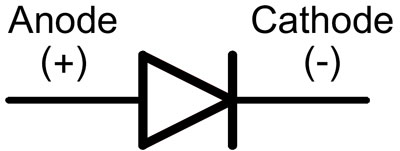
In een diode worden de aansluitdraden de anode en de kathode genoemd. De stroom zal door de diode vloeien als de anodekabel aan de 'plus' en de kathodedraad aan de 'min' is verbonden.
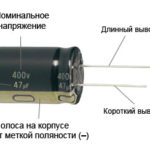
Voor een nieuwe LED met ongeslepen pinnen worden de anode en kathode visueel bepaald door de lengte. De kathode is korter.

Als de contacten doorgesneden zijn, zal een batterij eraan helpen. Licht zal verschijnen wanneer de polariteiten overeenkomen.
Het teken van de anode en de kathode
In de elektrochemie is het correcter te spreken over de processen die zich op de elektroden afspelen in plaats van over de tekens van de elektroden. De reductiereactie vindt plaats aan de kathode en de oxidatiereactie aan de anode.
In de elektrotechniek is de kathode verbonden met de negatieve pool van de stroombron en de anode met de positieve pool.
Verwante artikelen: