La question de savoir ce qu'est l'électrolyse est discutée depuis le cours de physique de l'école et n'est pas un secret pour la plupart des gens. Une autre chose est son importance et son application pratique. Ce procédé est utilisé avec grand avantage dans diverses industries et peut s'avérer utile pour le bricoleur à domicile.
Contenu
- 1 Qu'est-ce que l'électrolyse ?
- 2 Les lois de l'électrolyse de Faraday
- 3 Électrolyse de la fonte
- 4 Caractéristiques de l'électrolyse en solution
- 5 Électrolyse dans les gaz
- 6 Caractéristiques des processus se produisant à la cathode et à l'anode
- 7 Facteurs affectant le processus d'électrolyse
- 8 Où l'électrolyse est-elle appliquée ?
- 9 Coûts énergétiques
Qu'est-ce que l'électrolyse ?
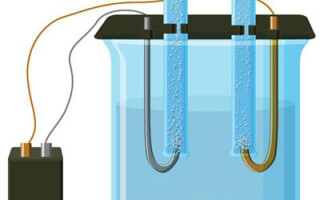
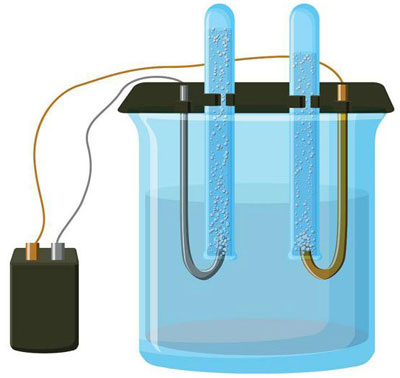
L'électrolyse est un complexe de processus spécifiques dans un système d'électrode et d'électrolyte avec un courant électrique constant. Son mécanisme est basé sur la génération d'un courant ionique. L'électrolyte est un conducteur de type 2 (conductivité ionique) dans lequel la dissociation électrolytique se produit. Il s'agit d'une décomposition en ions positifs (cation) et négative (anion) charge.
Un système d'électrolyse contient nécessairement une source positive (anode) et un négatif (cathode). Lorsqu'un courant électrique continu est appliqué, les cations se déplacent vers la cathode et les anions vers l'anode. Les cations sont principalement des ions métalliques et de l'hydrogène, et les anions sont de l'oxygène et du chlore. À la cathode, les cations gagnent des électrons en excès, permettant ainsi la réaction de réduction Men+ + ne → Me (où n est la valence du métal). À l'anode, au contraire, les électrons sont rendus par l'anion, la réaction d'oxydation ayant lieu.
Ainsi, le processus redox est assuré dans le système. Ce qui est important, cependant, c'est que ce processus nécessite de l'énergie. Celle-ci doit être fournie par une source de courant externe.
Les lois de l'électrolyse de Faraday
Le grand physicien M. Faraday a non seulement permis par ses recherches de comprendre la nature de l'électrolyse, mais aussi d'effectuer les calculs nécessaires à sa mise en œuvre. En 1832 apparaissent ses lois, qui relient les principaux paramètres des processus en cours.
La première loi
La première loi de Faraday stipule que la masse de matière réduite sur l'anode est directement proportionnelle à la charge électrique induite dans l'électrolyte : m = kq = k*I*t, où q est la charge, k est le coefficient ou l'équivalent électrochimique de la substance, I est le courant qui traverse l'électrolyte, t est le temps de passage du courant.

Deuxième loi
La deuxième loi de Faraday a permis de déterminer le coefficient de proportionnalité k. Elle se lit comme suit : l'équivalent électrochimique de toute substance est directement proportionnel à sa masse molaire et inversement proportionnel à sa valence. La loi est exprimée sous la forme :

k = 1/F*A/zoù F est la constante de Faraday, A est la masse molaire de la substance, z est sa valence chimique.
En tenant compte de ces deux lois, nous pouvons dériver la formule finale pour calculer la masse de la substance déposée sur l'électrode : m = A*I*t/(n*F)où n est le nombre d'électrons impliqués dans l'électrolyse. Généralement, n correspond à la charge de l'ion. D'un point de vue pratique, il est important de mettre en relation la masse de la substance avec le courant appliqué, ce qui permet de contrôler le processus en faisant varier sa force.
Électrolyse de la fonte
Une variante de l'électrolyse consiste à utiliser une masse fondue comme électrolyte. Dans ce cas, seuls les ions de fusion sont impliqués dans le processus électrolytique. Un exemple classique est l'électrolyse du sel fondu NaCl (sel de table). Les ions négatifs se précipitent vers l'anode, ce qui signifie que du gaz est libéré (Cl). A la cathode, il y aura une réduction du métal, c'est-à-dire le dépôt de Na pur, formé à partir des ions positifs, qui ont attiré les électrons en excès. D'autres métaux peuvent être produits de manière similaire (K, Ca, Li etc.) provenant de la dissolution des sels respectifs.
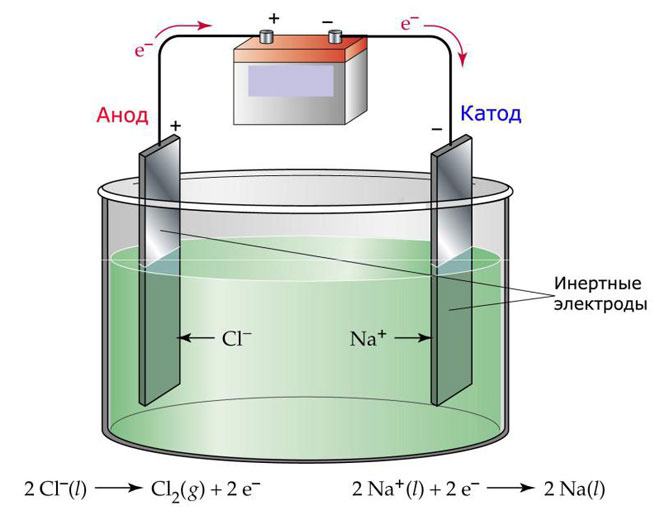
Dans l'électrolyse en fusion, les électrodes ne subissent pas de dissolution, mais participent uniquement à la source de courant. Du métal, du graphite et certains semi-conducteurs peuvent être utilisés dans leur fabrication. Il est important que le matériau ait une conductivité suffisante. L'un des matériaux les plus courants est le cuivre.
Caractéristiques de l'électrolyse en solution
L'électrolyse dans une solution aqueuse est très différente de l'électrolyse en fusion. Dans ce cas, il y a 3 processus concurrents : l'oxydation de l'eau qui dégage de l'oxygène, l'oxydation de l'anion et la dissolution anodique du métal. Le processus fait intervenir des ions d'eau, l'électrolyte et l'anode. En conséquence, la réduction de l'hydrogène, des cations de l'électrolyte et du métal de l'anode peut avoir lieu à la cathode.

La capacité de ces processus concurrents à se produire dépend du potentiel électrique du système. Seul le processus qui nécessite le moins d'énergie externe aura lieu. Par conséquent, les cations ayant le potentiel d'électrode le plus élevé seront réduits à la cathode, et les anions ayant le potentiel le plus faible seront oxydés à l'anode. Le potentiel d'électrode de l'hydrogène est considéré comme "0". Par exemple, en potassium, il est égal à (-2,93 В), le sodium est (-2,71 В), le plomb (-0,13 В), et pour l'argent c'est (+0,8 В).
Électrolyse dans les gaz
Le gaz ne peut agir comme un électrolyte que si un ionisateur est présent. Dans ce cas, le courant traverse le milieu ionisé, provoquant le processus nécessaire aux électrodes. Les lois de Faraday ne s'appliquent pas à l'électrolyse des gaz. Ces conditions sont nécessaires à sa réalisation :
- Ni la haute tension ni le courant élevé ne peuvent aider sans une ionisation artificielle du gaz.
- Seuls les acides gazeux sans oxygène et certains gaz conviennent à l'électrolyse.
Important ! Le processus se déroulera de manière similaire à l'électrolyse dans un électrolyte liquide si les conditions nécessaires sont remplies.
Caractéristiques des processus se déroulant à la cathode et à l'anode
Pour l'application pratique de l'électrolyse, il est important de comprendre ce qui se passe aux deux électrodes lorsqu'un courant électrique est appliqué. Les processus suivants sont caractéristiques :
- Cathode. Les ions chargés positivement se précipitent vers elle. C'est là que se produit la réduction des métaux ou la libération d'hydrogène. Plusieurs catégories de métaux peuvent être distinguées en fonction de leur activité cationique. Les métaux tels que Li, K, Ba, St, Ca, Na, Mg, Be, Al ne sont bien réduits qu'à partir de sels fondus. Si une solution est utilisée, l'hydrogène est libéré par l'électrolyse de l'eau. Les métaux suivants peuvent être récupérés en solution, mais à une concentration suffisante de cations : Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Le processus est plus facile pour Ag, Cu, Bi, Pt, Au, Hg.
- Anode. Les ions chargés négativement sont amenés à cette électrode. En s'oxydant, ils arrachent des électrons au métal, ce qui entraîne leur dissolution anodique, c'est-à-dire Les anions sont transformés en ions chargés positivement, qui sont dirigés vers la cathode. Les anions sont également subdivisés en fonction de leur activité. Seuls les anions PO4, CO3, SO4, NO3, NO2, ClO4, F peuvent être évacués des fontes. Dans les solutions aqueuses, ils ne sont pas soumis à l'électrolyse, mais à l'eau avec libération d'oxygène. Les anions tels que OH, Cl, I, S et Br sont ceux qui réagissent le plus facilement.

Lors de l'électrolyse, il est important de tenir compte de la tendance à l'oxydation du matériau de l'électrode. On distingue les anodes inertes et les anodes actives. Les électrodes inertes sont constituées de graphite, de carbone ou de platine et ne participent pas à l'apport d'ions.
Facteurs affectant le processus d'électrolyse
Le processus d'électrolyse dépend des facteurs suivants
- La composition de l'électrolyte. Une influence importante est exercée par les différentes impuretés. Ceux-ci sont divisés en 3 types : les cations, les anions et les matières organiques. Les substances peuvent être plus ou moins négatives que le métal de base, et cela interfère avec le processus. Parmi les impuretés organiques, on trouve les polluants (par exemple les huiles) et les agents de surface. Leurs concentrations sont aux valeurs maximales admissibles.
- Densité de courant. Conformément à la loi de Faraday, la masse de la substance déposée augmente avec l'intensité du courant. Cependant, des circonstances défavorables apparaissent - polarisation concentrée, tension accrue, chauffage intense de l'électrolyte. Dans cette optique, il existe des valeurs optimales pour la densité de courant dans chaque cas.
- pH des électrolytes. L'acidité du milieu est également choisie en fonction des métaux. Par exemple, le pH optimal pour le zinc est de 140g/cc.
- Température de l'électrolyte. Cela a un effet ambigu. Lorsque la température augmente, le taux d'électrolyse augmente, mais l'activité des impuretés aussi. Il existe une température optimale pour chaque processus. Elle se situe généralement entre 38 et 45 degrés.
Important ! L'électrolyse peut être accélérée ou ralentie par différentes influences et par le choix de la composition de l'électrolyte. Pour chaque application, il existe un régime différent qui doit être strictement respecté.
Où l'électrolyse est-elle utilisée ?
L'électrolyse est utilisée dans de nombreuses applications. Il existe plusieurs utilisations principales qui peuvent être distinguées pour des résultats pratiques.
Electroplacage
Des revêtements métalliques minces et résistants peuvent être appliqués par électrolyse. L'objet revêtu est placé dans un bain servant de cathode et l'électrolyte contient un sel du métal souhaité. C'est ainsi que vous pouvez recouvrir l'acier de zinc, de chrome ou d'étain.

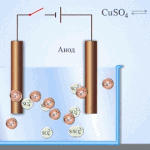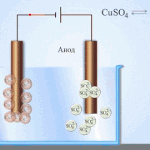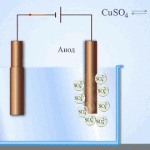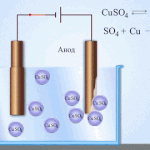
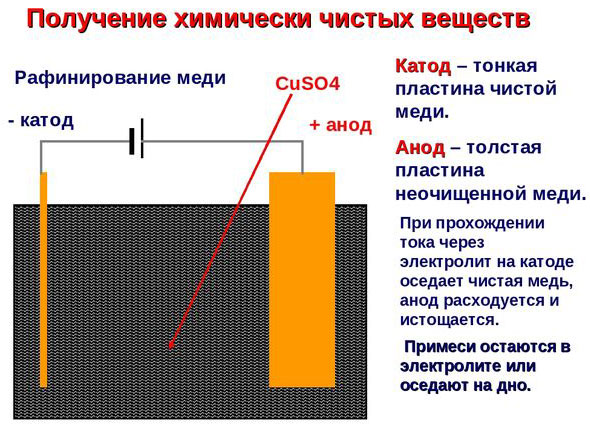
Electro-affinage - raffinage du cuivre
Voici un exemple de procédé d'électrotraitement cathode - cuivre pur anode - le cuivre avec des impuretés, électrolyte - solution aqueuse de sulfate de cuivre. Le cuivre de l'anode se transforme en ions et se dépose dans la cathode sans aucune impureté.
Extraction de métaux
Pour extraire les métaux des sels, les métaux sont fondus, puis électrolysés dans la masse fondue. Ce procédé est très efficace pour la récupération de l'aluminium à partir de la bauxite, du sodium et du potassium.

Anodisation
Dans ce procédé, le revêtement est fabriqué à partir de composés non métalliques. L'exemple classique est l'anodisation de l'aluminium. La partie en aluminium est montée comme une anode. L'électrolyte est une solution d'acide sulfurique. À la suite de l'électrolyse, une couche d'oxyde d'aluminium se dépose sur l'anode, qui possède des propriétés protectrices et décoratives. Les technologies ci-dessus sont largement utilisées dans différentes industries. Il est également possible de réaliser les processus de ses propres mains et en toute sécurité.
Coûts énergétiques
L'électrolyse nécessite une grande quantité d'énergie. Le procédé aura une valeur pratique si le courant anodique est suffisant, ce qui nécessite l'application d'un courant continu important à partir de la source d'alimentation. En outre, il produit des pertes de tension latérales - surtensions anodiques et cathodiques, et des pertes dans l'électrolyte en raison de sa résistance. Le rendement d'une installation est déterminé en rapportant la puissance de l'apport énergétique à l'unité de masse utile de la substance obtenue.
L'électrolyse est utilisée depuis longtemps dans l'industrie avec une grande efficacité. L'anodisation et l'électrodéposition sont devenues courantes dans la vie quotidienne. L'extraction et le traitement des matériaux permettent d'extraire de nombreux métaux du minerai. Le processus peut être planifié et calculé en connaissant ses schémas de base.
Articles connexes :