Il est souvent difficile de déterminer quelle électrode est la cathode et quelle électrode est l'anode. Un bon début est de définir les termes.
Le concept de cathode et d'anode - une explication simple
Dans les substances complexes, les électrons entre les atomes des composés ne sont pas répartis de manière égale. L'interaction fait que les particules se déplacent d'un atome d'une substance à un atome d'une autre. Cette réaction est appelée réaction d'oxydoréduction. La perte d'électrons est appelée oxydation, l'élément qui cède les électrons est appelé agent réducteur.
L'ajout d'électrons est appelé réduction, l'élément qui prend les électrons est appelé oxydant. Le transfert des électrons de l'agent réducteur à l'agent oxydant peut se faire par l'intermédiaire d'un circuit externe, et il peut alors être utilisé comme source d'énergie électrique. Les dispositifs qui convertissent l'énergie d'une réaction chimique en énergie électrique sont appelés cellules galvaniques.
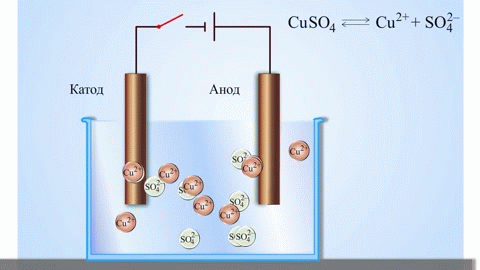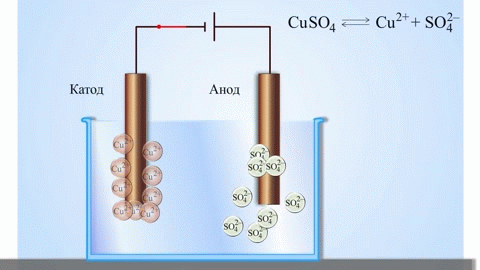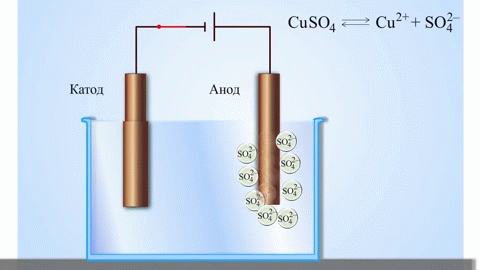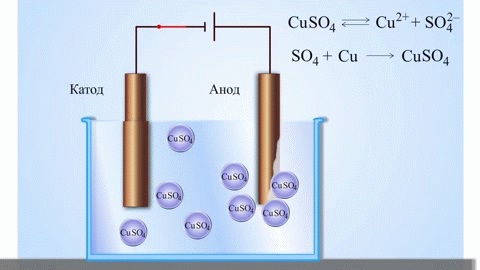
L'exemple classique le plus simple d'une cellule galvanique est constitué de deux plaques faites de métaux différents et immergées dans une solution électrolytique. Dans ce système, l'oxydation a lieu sur un métal et la réduction sur l'autre.
IMPORTANT ! L'électrode où l'oxydation a lieu est appelée l'anode. L'électrode où a lieu la réduction est appelée cathode.
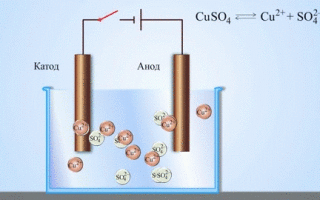
La pile galvanique cuivre-zinc, qui fonctionne en absorbant l'énergie de la réaction entre le zinc et le sulfate de cuivre, est un exemple familier dans les manuels de chimie des écoles. Dans le dispositif de Jacoby-Daniel, une plaque de cuivre est placée dans une solution de sulfate de cuivre (électrode de cuivre) et une plaque de zinc est immergée dans une solution de sulfate de zinc (électrode de zinc). L'électrode de zinc libère des cations dans la solution, créant un excès de charge positive dans celle-ci, tandis qu'à l'électrode de cuivre, la solution est appauvrie en cations, ici la solution est chargée négativement.
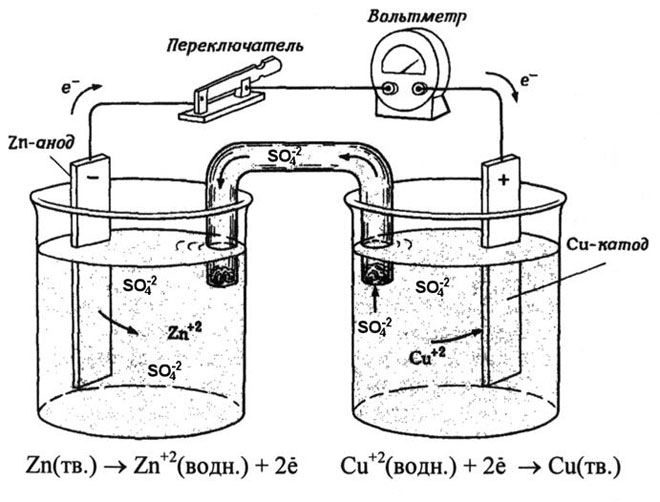
La fermeture du circuit externe fait circuler les électrons de l'électrode de zinc vers l'électrode de cuivre. Les relations d'équilibre aux frontières des phases sont interrompues. La réaction d'oxydoréduction a lieu.
L'énergie de la réaction chimique spontanée est convertie en énergie électrique.
Si la réaction chimique est provoquée par une énergie électrique externe, il se produit un processus appelé électrolyse. Les processus qui se produisent pendant l'électrolyse sont l'inverse de ceux qui se produisent pendant le fonctionnement de la cellule galvanique.
ATTENTION ! L'électrode, sur laquelle a lieu la réduction, est également appelée cathode, mais dans l'électrolyse, elle est chargée négativement et l'anode est chargée positivement.
Applications électrochimiques
Les anodes et les cathodes participent à de nombreuses réactions chimiques :
- L'électrolyse ;
- Electro-extraction ;
- Electroplacage ;
- Electroplacage.
L'électrolyse de composés fondus et de solutions aqueuses permet de produire des métaux, de les purifier de leurs impuretés et d'en extraire des composants précieux (affinage électrolytique). Les plaques sont coulées à partir du métal à affiner. Les plaques sont placées comme anodes dans l'électrolyseur. Le métal est dissous par un courant électrique. Ses cations passent dans la solution et sont évacués à la cathode, formant un précipité de métal pur. Les impuretés contenues dans la plaque métallique brute d'origine restent insolubles sous forme de boue anodique ou passent dans l'électrolyte où elles sont éliminées. Le cuivre, le nickel, le plomb, l'or, l'argent et l'étain subissent un raffinage électrolytique.
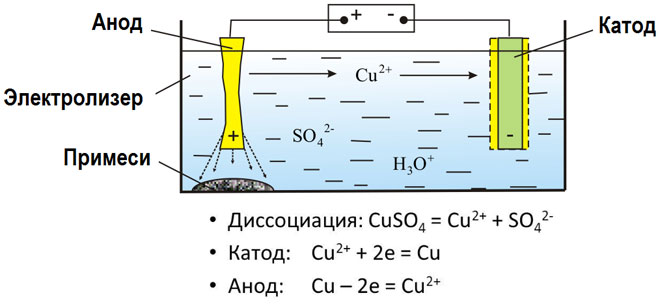
L'électro-extraction est le processus d'extraction du métal d'une solution au cours d'une électrolyse. Afin de transférer le métal en solution, il est traité avec des réactifs spéciaux. Le procédé permet de séparer le métal de haute pureté à la cathode. C'est ainsi que sont produits le zinc, le cuivre et le cadmium.
Pour éviter la corrosion, rendre le produit plus solide et plus décoratif, la surface d'un métal est recouverte d'un autre. Ce procédé est appelé galvanoplastie.

L'électroformage est le processus de fabrication de copies métalliques d'objets tridimensionnels par électrodéposition de métal.

Applications électroniques sous vide
Le principe de la cathode et de l'anode dans un appareil sous vide peut être démontré au moyen d'un tube électronique. Ça ressemble à une cuve hermétiquement fermée avec des pièces métalliques à l'intérieur. Le dispositif est utilisé pour rectifier, générer et convertir des signaux électriques. Une distinction est faite en fonction du nombre d'électrodes :
- diodes ;
- triodes ;
- tétrodes ;
- pentodes etc.
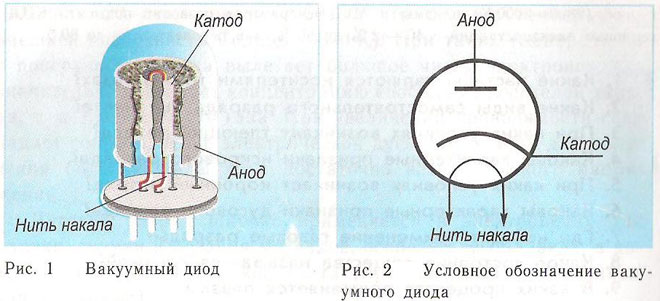
Une diode est un dispositif à vide comportant deux électrodes, une cathode et une anode. La cathode est reliée au pôle négatif de l'alimentation et l'anode au pôle positif. Le but de la cathode est d'émettre des électrons lorsqu'elle est chauffée par un courant électrique à une certaine température. Les électrons sont utilisés pour créer une charge d'espace entre la cathode et l'anode. Les électrons les plus rapides se précipitent vers l'anode, en passant la barrière de potentiel négatif de la charge d'espace. L'anode reçoit les particules. Un courant anodique est créé dans le circuit externe. Le flux d'électrons est contrôlé au moyen d'électrodes supplémentaires qui sont alimentées par un potentiel électrique. Les diodes sont utilisées pour convertir le courant alternatif en courant continu.
Applications électroniques
Aujourd'hui, on utilise des diodes de type semi-conducteur.
La propriété des diodes de faire passer le courant dans le sens direct et de ne pas le faire passer dans le sens inverse est largement utilisée en électronique.
Le fonctionnement d'une LED repose sur la propriété des cristaux semi-conducteurs de briller lorsqu'un courant traverse la jonction p-n dans le sens direct.
Sources galvaniques de courant continu - batteries
Les sources chimiques de courant électrique dans lesquelles se produisent des réactions réversibles sont appelées batteries rechargeables : elles sont rechargées et utilisées de manière répétée.

Lorsqu'une batterie au plomb fonctionne, une réaction d'oxydoréduction a lieu. Le plomb métallique est oxydé et cède ses électrons, ce qui réduit le dioxyde de plomb qui reprend les électrons. Le plomb métallique de la batterie est l'anode et est chargé négativement. Le dioxyde de plomb est la cathode et est chargé positivement.
Lorsque la pile se décharge, les substances de la cathode et de l'anode et leur électrolyte, l'acide sulfurique, sont consommées. Pour charger la batterie, elle est connectée à une source de courant (plus vers plus, moins vers moins). Le sens du courant est maintenant opposé à ce qu'il était lorsque la batterie était déchargée. Les processus électrochimiques aux électrodes sont "inversés". L'électrode de plomb devient alors la cathode, où se déroule le processus de réduction, et le dioxyde de plomb devient l'anode, où se déroule le processus d'oxydation. Les substances nécessaires à la batterie sont à nouveau créées dans la batterie.
Pourquoi y a-t-il une confusion ?
Le problème vient du fait qu'un signe particulier de charge ne peut être fermement attaché ni à l'anode ni à la cathode. Souvent, la cathode est l'électrode chargée positivement et l'anode est l'électrode négative. Souvent, mais pas toujours. Tout dépend du processus qui se déroule à l'électrode.
AVERTISSEMENT ! Une pièce qui a été placée dans l'électrolyte peut être à la fois l'anode et la cathode. Tout dépend de l'objectif du processus : appliquer une autre couche de métal ou enlever une couche de métal.
Comment identifier l'anode et la cathode
En électrochimie, l'anode est l'électrode où les processus d'oxydation ont lieu, la cathode est l'électrode où la réduction a lieu.
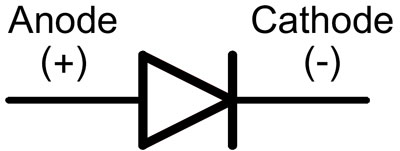
Dans une diode, les fils sont appelés anode et cathode. Le courant circule dans la diode si le fil de l'anode est connecté au "plus" et le fil de la cathode au "moins".
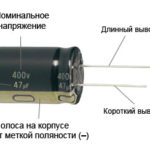
Pour une nouvelle LED avec des broches non coupées, l'anode et la cathode sont déterminées visuellement par la longueur. La cathode est plus courte.

Si les contacts sont coupés, une pile attachée à ces derniers sera utile. La lumière apparaît lorsque les polarités correspondent.
Le signe de l'anode et de la cathode
En électrochimie, il est plus correct de parler des processus qui se déroulent sur les électrodes plutôt que des signes des électrodes. La réaction de réduction a lieu à la cathode et la réaction d'oxydation a lieu à l'anode.
En électrotechnique, la cathode est connectée au pôle négatif de la source de courant et l'anode au pôle positif.
Articles connexes :