Kysymys siitä, mitä elektrolyysi on, on ollut esillä koulun fysiikan kurssista lähtien, eikä se ole useimmille ihmisille mikään salaisuus. Toinen asia on sen merkitys ja käytännön soveltaminen. Tätä prosessia käytetään hyödyksi eri teollisuudenaloilla, ja se voi olla kätevä myös kodin askartelijalle.
Sisältö
Mitä elektrolyysi on?
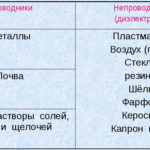
Elektrolyysi on erityisten prosessien kokonaisuus elektrodi- ja elektrolyyttijärjestelmässä, jonka läpi virtaa jatkuva sähkövirta. Sen mekanismi perustuu ionivirran syntymiseen. Elektrolyytti on tyypin 2 johdin (ionijohtokyky), jossa tapahtuu elektrolyyttinen dissosiaatio. Tämä tarkoittaa hajoamista ioneiksi, joilla on positiivinen (kation) ja negatiivinen (anioni) maksu.
Elektrolyysijärjestelmä sisältää välttämättä positiivisen (anodi) ja negatiivinen (katodi) elektrodi. Kun sähkövirta on suora, kationit liikkuvat katodia kohti ja anionit anodia kohti. Kationit ovat pääasiassa metalli-ioneja ja vetyä, ja anionit ovat happea ja klooria. Katodilla kationit saavat ylimääräisiä elektroneja, mikä mahdollistaa pelkistysreaktion Men+ + ne → Me (jossa n on metallin valenssi). Anodilla sen sijaan anionilta annetaan elektroneja takaisin, jolloin tapahtuu hapetusreaktio.
Näin varmistetaan redox-prosessi järjestelmässä. Tärkeää on kuitenkin se, että prosessi vaatii energiaa. Tämä on annettava ulkoisesta virtalähteestä.
Faradayn elektrolyysilait
Suuri fyysikko M. Faraday mahdollisti tutkimuksillaan paitsi elektrolyysin luonteen ymmärtämisen myös sen toteuttamiseksi tarvittavat laskelmat. Vuonna 1832 ilmestyivät hänen lakinsa, jotka yhdistivät tapahtuvien prosessien tärkeimmät parametrit.
Ensimmäinen laki
Faradayn ensimmäisen lain mukaan anodilla pelkistyvän aineen massa on suoraan verrannollinen elektrolyyttiin indusoituvaan sähkövaraukseen: m = kq = k*I*t, jossa q on varaus, k on aineen kerroin tai sähkökemiallinen ekvivalentti, I on elektrolyytin läpi kulkeva virta ja t on virran kulumisen aika.

Toinen laki
Faradayn toisen lain avulla voitiin määrittää suhteellisuuskerroin k. Se kuuluu seuraavasti: minkä tahansa aineen sähkökemiallinen ekvivalentti on suoraan verrannollinen sen moolimassaan ja kääntäen verrannollinen sen valenssiin. Laki ilmaistaan muodossa:

k = 1/F*A/zjossa F on Faradayn vakio, A on aineen moolimassa ja z on sen kemiallinen valenssi.
Kun molemmat lait otetaan huomioon, voidaan johtaa lopullinen kaava elektrodille laskeutuvan aineen massan laskemiseksi: m = A*I*t/(n*F)jossa n on elektrolyysiin osallistuvien elektronien lukumäärä. Yleensä n vastaa ionin varausta. Käytännön kannalta on tärkeää, että aineen massa suhteutetaan syötettyyn virtaan, jolloin prosessia voidaan ohjata muuttamalla sen voimakkuutta.
Sulan elektrolyysi
Yksi elektrolyysin muunnelma on käyttää elektrolyyttinä sulaa. Tällöin elektrolyysiprosessiin osallistuvat vain sulan ionit. Klassinen esimerkki on suolasulan NaCl:n elektrolyysi (ruokasuola). Negatiiviset ionit ryntäävät anodille, jolloin kaasua vapautuu (Cl). Katodilla tapahtuu metallin pelkistyminen, eli puhdas Na laskeutuu, joka muodostuu positiivisista ioneista, jotka ovat vetäneet puoleensa ylimääräisiä elektroneja. Muita metalleja voidaan valmistaa vastaavalla tavalla (K, Ca, Li jne.) vastaavien suolojen liukenemisesta.
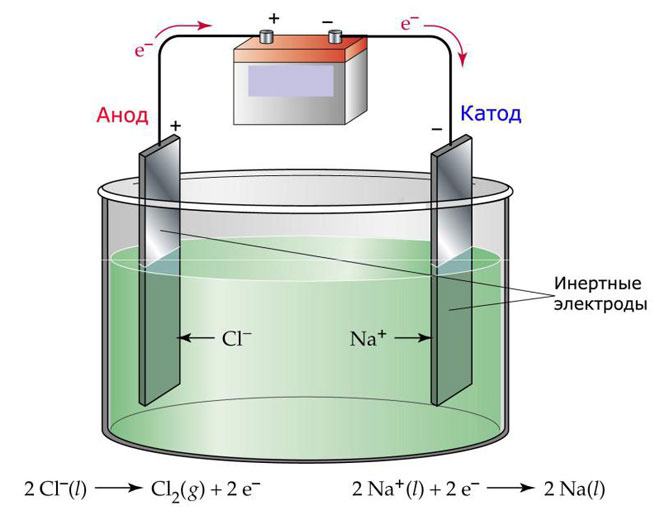
Sulaelektrolyysissä elektrodit eivät liukene, vaan ne toimivat ainoastaan virtalähteenä. Niiden valmistuksessa voidaan käyttää metallia, grafiittia ja joitakin puolijohteita. On tärkeää, että materiaalin johtavuus on riittävä. Yksi yleisimmistä materiaaleista on kupari.
Elektrolyysin ominaisuudet liuoksissa
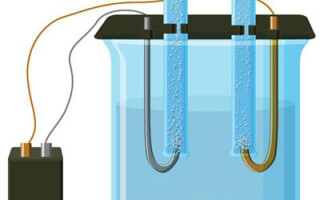
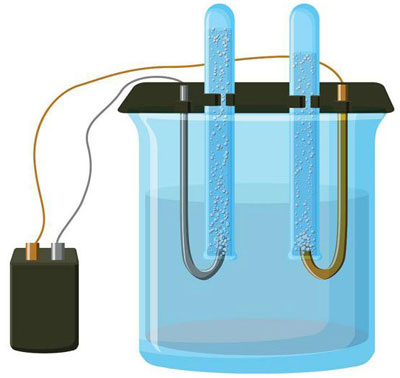
Elektrolyysi vesiliuoksessa on aivan erilainen kuin sulaelektrolyysi. Tässä on kolme kilpailevaa prosessia: veden hapettuminen, jolloin happea vapautuu, anionin hapettuminen ja metallin anodinen liukeneminen. Prosessiin osallistuvat vesi-ionit, elektrolyytti ja anodi. Näin ollen vedyn, elektrolyyttikationien ja anodimetallin pelkistyminen voi tapahtua katodilla.

Näiden keskenään kilpailevien prosessien toteutuminen riippuu järjestelmän sähköpotentiaalista. Vain se prosessi, joka vaatii vähemmän ulkoista energiaa, tapahtuu. Näin ollen kationit, joilla on korkein elektrodipotentiaali, pelkistyvät katodilla ja anionit, joilla on alhaisin potentiaali, hapettuvat anodilla. Vedyn elektrodipotentiaaliksi otetaan 0. Esimerkiksi kaliumissa se on yhtä suuri kuin (-2,93 В), natrium on (-2,71 В), lyijy (-0,13 В), ja hopean osalta se on (+0,8 В).
Elektrolyysi kaasuissa
Kaasu voi toimia elektrolyyttinä vain, jos läsnä on ionisaattori. Tällöin virta kulkee ionisoidun väliaineen läpi aiheuttaen tarvittavan prosessin elektrodeissa. Faradayn lakeja ei sovelleta kaasuelektrolyysiin. Tällaiset olosuhteet ovat välttämättömiä sen toteutumiselle:
- Suurjännite tai suuri virta eivät auta ilman kaasun keinotekoista ionisointia.
- Vain hapettomat kaasumaiset hapot ja tietyt kaasut soveltuvat elektrolyysiin.
Tärkeää! Prosessi toimii samalla tavalla kuin elektrolyysi nestemäisessä elektrolyytissä, jos tarvittavat edellytykset täyttyvät.
Katodilla ja anodilla tapahtuvien prosessien ominaisuudet
Elektrolyysin käytännön soveltamisen kannalta on tärkeää ymmärtää, mitä molemmissa elektrodeissa tapahtuu, kun niihin kytketään sähkövirta. Seuraavat prosessit ovat tyypillisiä:
- Katodi. Positiivisesti varautuneet ionit ryntäävät sitä kohti. Täällä tapahtuu metallien pelkistyminen tai vedyn vapautuminen. Metalleja voidaan erottaa useita eri luokkia niiden kationisen aktiivisuuden perusteella. Metallit, kuten Li, K, Ba, St, Ca, Na, Mg, Be ja Al, pelkistyvät hyvin vain sulasta suolasta. Jos käytetään liuosta, vety vapautuu veden elektrolyysin kautta. Seuraavat metallit voidaan ottaa talteen liuoksessa, mutta riittävällä kationipitoisuudella: Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Prosessi on helpoin Ag:n, Cu:n, Bi:n, Pt:n, Au:n ja Hg:n osalta.
- Anodi. Tähän elektrodiin syötetään negatiivisesti varautuneita ioneja. Hapettuessaan ne vievät elektroneja pois metallista, mikä johtaa niiden anodiseen liukenemiseen, ts. Anionit muuttuvat positiivisesti varautuneiksi ioneiksi, jotka suuntautuvat kohti katodia. Anionit jaetaan myös niiden aktiivisuuden mukaan. Ainoastaan anionit PO4, CO3, SO4, NO3, NO2, ClO4, F voidaan poistaa sulasta. Vesiliuoksissa ne eivät altistu elektrolyysille, vaan vedelle hapen vapautuessa. Helpoiten reagoivat anionit ovat OH, Cl, I, S ja Br.

Elektrolyysin aikaansaamisessa on tärkeää ottaa huomioon elektrodimateriaalin taipumus hapettua. Inertit ja aktiiviset anodit erotetaan toisistaan. Inertit elektrodit on valmistettu grafiitista, hiilestä tai platinasta, eivätkä ne osallistu ionien syöttöön.
Elektrolyysiprosessiin vaikuttavat tekijät
Elektrolyysiprosessi riippuu seuraavista tekijöistä
- Elektrolyytin koostumus. Eri epäpuhtaudet vaikuttavat merkittävästi. Nämä jaetaan kolmeen tyyppiin - kationit, anionit ja orgaaniset aineet. Aineet voivat olla enemmän tai vähemmän negatiivisia kuin perusmetalli, mikä häiritsee prosessia. Orgaanisten epäpuhtauksien joukossa on epäpuhtauksia (esim. öljyjä) ja pinta-aktiivisia aineita. Niiden pitoisuudet ovat suurimmissa sallituissa arvoissa.
- Virrantiheys. Faradayn lain mukaan laskeutuvan aineen massa kasvaa virran voimakkuuden myötä. Epäsuotuisat olosuhteet kuitenkin syntyvät - keskittynyt polarisaatio, lisääntynyt jännite, elektrolyytin voimakas kuumeneminen. Tämän vuoksi virrantiheydelle on olemassa optimaaliset arvot kussakin tapauksessa.
- elektrolyytin pH. Myös väliaineen happamuus valitaan metallit huomioon ottaen. Esimerkiksi sinkin optimaalinen pH-arvo on 140 g/cc.
- Elektrolyytin lämpötila. Tällä on epäselvä vaikutus. Lämpötilan noustessa elektrolyysinopeus kasvaa, mutta myös epäpuhtauksien aktiivisuus kasvaa. Kullekin prosessille on olemassa optimaalinen lämpötila. Se on yleensä 38-45 astetta.
Tärkeää! Elektrolyysiä voidaan kiihdyttää tai hidastaa erilaisilla vaikutuksilla ja elektrolyyttikoostumuksen valinnalla. Jokaista sovellusta varten on olemassa erilainen järjestelmä, jota on noudatettava tarkasti.
Missä elektrolyysiä käytetään?
Elektrolyysiä käytetään monissa sovelluksissa. Käytännön tulosten kannalta voidaan erottaa useita pääkäyttötarkoituksia.
Galvanointi
Ohuita, sitkeitä galvanoituja metallipinnoitteita voidaan levittää elektrolyysillä. Päällystetty kappale asetetaan kylpyyn katodiksi, ja elektrolyytti sisältää halutun metallin suolan. Näin voit pinnoittaa teräksen sinkillä, kromilla tai tinalla.

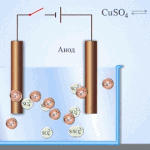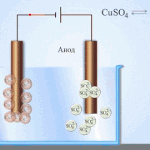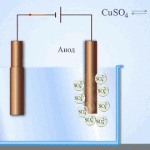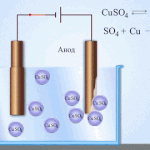
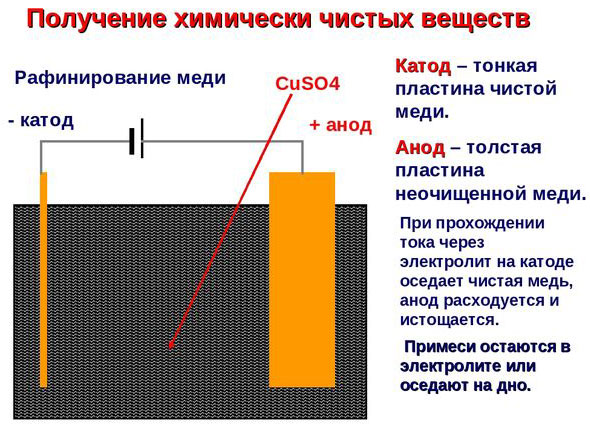
Sähköpuhdistus - kuparin puhdistaminen
Esimerkki sähkökäsittelyprosessista on seuraava katodi - puhdasta kuparia anodi - kupari, jossa on epäpuhtauksia, elektrolyytti - vesipitoinen kuparisulfaattiliuos. Anodilta tuleva kupari muuttuu ioneiksi ja laskeutuu katodille ilman epäpuhtauksia.
Metallien talteenotto
Metallien erottamiseksi suoloista metallit sulatetaan ja sitten elektrolyysoidaan sulassa. Tämä prosessi on varsin tehokas alumiinin talteenotossa bauksiitista, natriumista ja kaliumista.

Anodisointi
Tässä prosessissa pinnoite valmistetaan ei-metallisista yhdisteistä. Klassinen esimerkki on alumiinin anodisointi. Alumiiniosa on asennettu anodin tavoin. Elektrolyytti on rikkihappoliuos. Elektrolyysin tuloksena anodille kerrostuu alumiinioksidikerros, jolla on suojaavia ja koristeellisia ominaisuuksia. Edellä mainittuja tekniikoita käytetään laajalti eri teollisuudenaloilla. Prosessit on myös mahdollista suorittaa omin käsin ja turvallisesti.
Energiakustannukset
Elektrolyysi vaatii paljon energiaa. Prosessi on käytännössä käyttökelpoinen, jos anodivirta on riittävä, mikä edellyttää merkittävää tasavirtaa virtalähteestä. Lisäksi se aiheuttaa sivujännitehäviöitä - anodisia ja katodisia ylijännitteitä - ja elektrolyytin resistanssista johtuvia häviöitä. Laitoksen hyötysuhde määritetään suhteuttamalla syötetyn energian teho saadun aineen hyötymassan yksikköön.
Elektrolyysiä on jo pitkään käytetty teollisuudessa erittäin tehokkaasti. Anodisoinnista ja galvanoinnista on tullut arkipäivää, ja materiaalin louhinta ja käsittely auttavat louhimaan monia metalleja malmista. Prosessi voidaan suunnitella ja laskea tuntemalla sen perusmallit.
Aiheeseen liittyvät artikkelit: