Det er ofte et problem at afgøre, hvilken elektrode der er katode og hvilken der er anode. En god start er at definere begreberne.
Indhold
Begrebet katode og anode - en simpel forklaring
I komplekse stoffer er elektronerne mellem atomerne i forbindelserne ikke ligeligt fordelt mellem atomerne i forbindelserne. Vekselvirkningen får partikler til at bevæge sig fra et atom af et stof til et atom af et andet stof. Reaktionen kaldes en oxidations-reduktionsreaktion. Tabet af elektroner kaldes oxidation, og det element, der afgiver elektronerne, kaldes reduktionsmidlet.
Tilføjelsen af elektroner kaldes reduktion, og det element, der modtager elektronerne, kaldes oxidationsmidlet. Overførslen af elektroner fra reduktionsmidlet til oxidationsmidlet kan finde sted gennem et eksternt kredsløb, og derefter kan det bruges som en kilde til elektrisk energi. Enheder, der omdanner energien fra en kemisk reaktion til elektrisk energi, kaldes galvaniske celler.
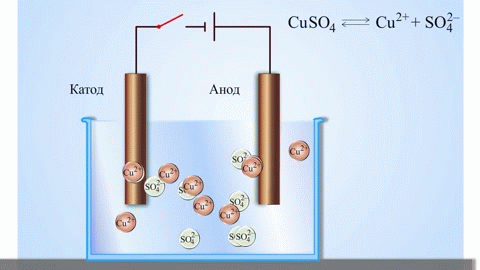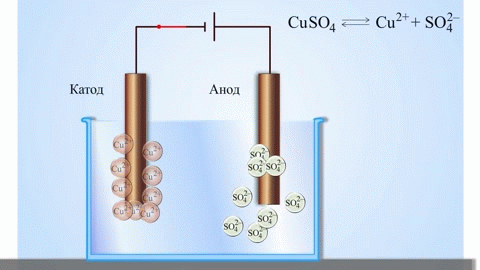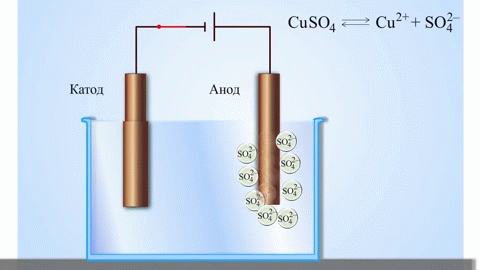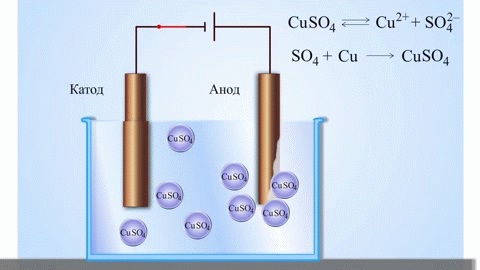
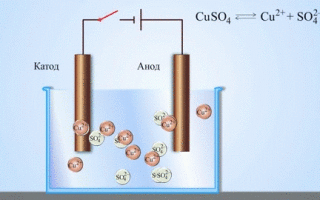
Det mest enkle klassiske eksempel på en galvanisk celle er to plader af forskellige metaller, der er nedsænket i en elektrolytopløsning. I dette system finder oxidation sted på det ene metal og reduktion på det andet.
VIGTIGT! Den elektrode, hvor oxidationen finder sted, kaldes anoden. Den elektrode, hvor reduktionen finder sted, kaldes katoden.
En galvanisk kobber-zink-celle, som fungerer ved at absorbere energien fra reaktionen mellem zink og kobbersulfat, er et velkendt eksempel fra skolens kemilærebøger. I Jacoby-Daniel-anordningen placeres en kobberplade i en kobbersulfatopløsning (kobberelektrode) og en zinkplade nedsænkes i en zinksulfatopløsning (zinkelektrode). Zinkelektroden afgiver kationer til opløsningen, hvilket skaber en overskydende positiv ladning i den, mens opløsningen ved kobberelektroden er tømt for kationer, og opløsningen er negativt ladet.
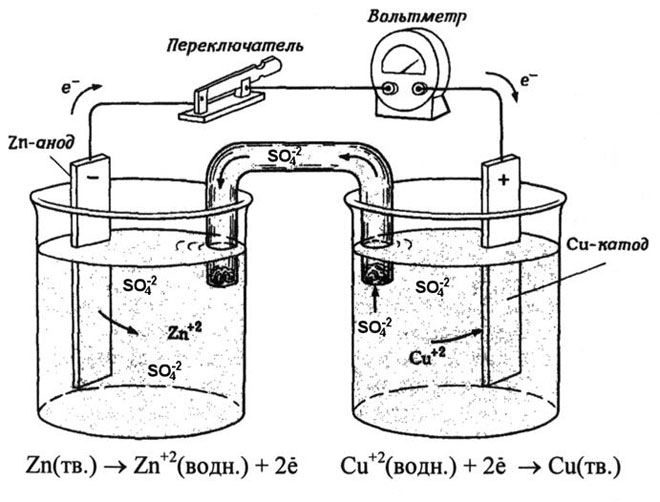
Lukning af det eksterne kredsløb får elektroner til at strømme fra zinkelektroden til kobberelektroden. Ligevægtsforholdene ved fasegrænserne er afbrudt. Redoxreaktionen finder sted.
Energien fra den spontane kemiske reaktion omdannes til elektrisk energi.
Hvis den kemiske reaktion fremkaldes af ekstern elektrisk energi, opstår der en proces, der kaldes elektrolyse. De processer, der finder sted under elektrolyse, er de omvendte af dem, der finder sted under galvaniske celler.
OPMÆRKSOMHED! Den elektrode, hvor reduktionen finder sted, kaldes også katode, men i elektrolyse er den negativt ladet, mens anoden er positivt ladet.
Elektrokemiske anvendelser
Anoder og katoder deltager i mange kemiske reaktioner:
- Elektrolyse;
- Elektroekstraktion;
- Galvanisering;
- Galvanisering.
Elektrolyse af smeltede forbindelser og vandige opløsninger producerer metaller, renser metaller for urenheder og udvinder værdifulde komponenter (elektrolytisk raffinering). Pladerne støbes af det metal, der skal raffineres. Pladerne placeres som anoder i elektrolysereren. Metallet opløses af en elektrisk strøm. Dets kationer passerer ind i opløsningen og udledes ved katoden, hvor de danner et udfældningsprodukt af rent metal. De urenheder, der er indeholdt i den oprindelige rå metalplade, forbliver enten uopløselige som et anodeslam eller går over i elektrolytten, hvor de fjernes. Kobber, nikkel, bly, guld, sølv og tin undergår elektrolytisk raffinering.
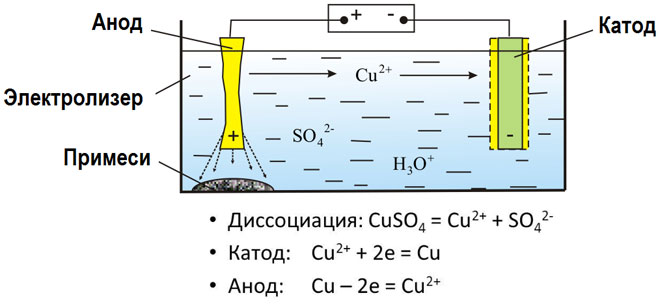
Elektroekstraktion er processen til at udvinde metal fra en opløsning under elektrolyse. For at overføre metallet til opløsningen behandles det med særlige reagenser. Ved processen udskilles metal af høj renhed ved katoden. Det er sådan, zink, kobber og cadmium fremstilles.
For at undgå korrosion, gøre produktet stærkere og mere dekorativt, belægges overfladen af et metal med et andet. Denne proces kaldes elektroplettering.

Elektroformning er processen til fremstilling af metalkopier af tredimensionelle objekter ved elektrodeposition af metal.

Vakuumelektroniske anvendelser
Princippet om katode og anode i et vakuumapparat kan demonstreres ved hjælp af et elektronrør. Det ligner en hermetisk lukket beholder med metaldele indeni. Enheden bruges til at ensrette, generere og konvertere elektriske signaler. Der skelnes efter antallet af elektroder:
- dioder;
- trioder;
- tetroder;
- pentoder osv.
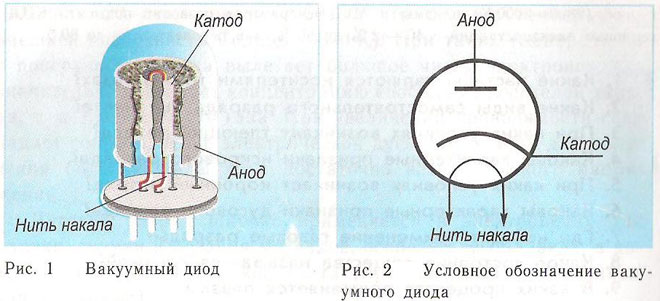
En diode er en vakuumanordning med to elektroder, en katode og en anode. Katoden er forbundet til strømforsyningens negative pol og anoden til den positive pol. Formålet med katoden er at udsende elektroner, når den opvarmes af en elektrisk strøm til en bestemt temperatur. Elektronerne bruges til at skabe en rumladning mellem katoden og anoden. De hurtigste elektroner styrter mod anoden og passerer den negative potentielle barriere af rumladningen. Anoden modtager partiklerne. Der opstår anodisk strøm i det eksterne kredsløb. Elektronstrømmen styres ved hjælp af yderligere elektroder, der tilføres et elektrisk potentiale. Dioderne bruges til at konvertere vekselstrømmen til jævnstrøm.
Elektroniske applikationer
I dag anvendes halvlederdioder af halvledertyper.
Diodernes egenskab til at lade strømmen passere i fremadgående retning og ikke at lade strømmen passere i omvendt retning er meget udbredt i elektronikken.
En LED er baseret på halvlederkrystallers egenskab til at lyse, når der går en strøm gennem p-n-forbindelsen i fremadgående retning.
Galvaniske jævnstrømskilder - batterier
Kemiske kilder til elektrisk strøm, hvor reversible reaktioner finder sted, kaldes genopladelige batterier: de kan genoplades og bruges gentagne gange.

Når et bly-syre-batteri fungerer, finder der en redoxreaktion sted. Det metalliske bly oxideres og afgiver sine elektroner, hvilket reducerer blydioxid, der optager elektronerne. Det metalliske bly i batteriet er anoden og er negativt ladet. Blydioxid er katoden og er positivt ladet.
Når batteriet aflades, forbruges stofferne i katoden og anoden og deres elektrolyt, svovlsyre, når batteriet er afladet. For at oplade batteriet tilsluttes det til en strømkilde (plus til plus, minus til minus). Strømmen har nu den modsatte retning af den retning, som den havde, da batteriet blev afladet. De elektrokemiske processer ved elektroderne er "omvendte". Blyelektroden bliver nu katode, hvor reduktionsprocessen finder sted, og blydioxid bliver anode, hvor oxidationsprocessen finder sted. De stoffer, der er nødvendige for batteriet, dannes igen i batteriet.
Hvorfor er der forvirring?
Problemet opstår, fordi et bestemt ladningstegn ikke kan knyttes fast til hverken anoden eller katoden. Ofte er katoden den positivt ladede elektrode, og anoden er den negative elektrode. Ofte, men ikke altid. Det hele afhænger af den proces, der finder sted ved elektroden.
ADVARSEL! En del, der er anbragt i elektrolytten, kan være både anode og katode. Det afhænger alt sammen af formålet med processen: at påføre et andet lag metal eller at fjerne et lag metal.
Sådan identificeres anoden og katoden
I elektrokemi er anoden den elektrode, hvor oxidationsprocesser finder sted, og katoden er den elektrode, hvor reduktion finder sted.
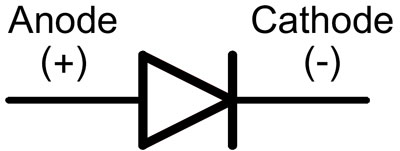
I en diode kaldes ledningerne anode og katode. Strømmen vil løbe gennem dioden, hvis anodekablet er forbundet til "plus" og katodekablet til "minus".
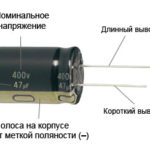
For en ny LED med uklippede pins bestemmes anoden og katoden visuelt ved hjælp af længden. Katoden er kortere.

Hvis kontakterne er afskåret, hjælper et batteri, der er fastgjort til dem. Der kommer lys, når polariteterne passer sammen.
Anodens og katodens fortegn
I elektrokemi er det mere korrekt at tale om de processer, der foregår på elektroderne, i stedet for om elektrodernes tegn. Reduktionsreaktionen finder sted på katoden, og oxidationsreaktionen finder sted på anoden.
Inden for elektroteknik er katoden forbundet til strømkildens negative pol og anoden til den positive pol.
Relaterede artikler: