O tom, čo je elektrolýza, sa diskutuje už od školského kurzu fyziky a pre väčšinu ľudí nie je žiadnym tajomstvom. Ďalšou vecou je jeho význam a praktické využitie. Tento proces sa s výhodou používa v rôznych priemyselných odvetviach a môže sa hodiť aj domácim majstrom.
Obsah
Čo je elektrolýza?
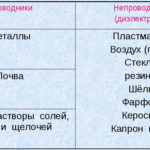
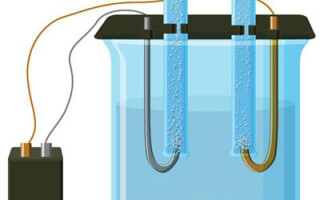
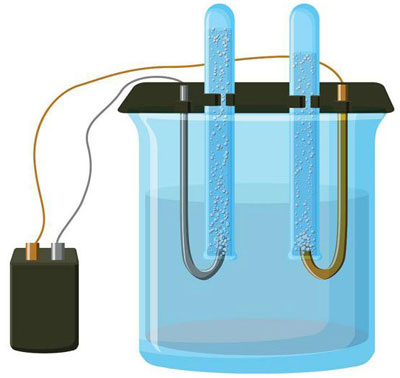
Elektrolýza je komplex špecifických procesov v systéme elektródy a elektrolytu, ktorým preteká konštantný elektrický prúd. Jeho mechanizmus je založený na generovaní iónového prúdu. Elektrolyt je vodič typu 2 (iónová vodivosť), v ktorom dochádza k elektrolytickej disociácii. Ide o rozklad na ióny s kladným (kation) a záporné (anión) poplatok.
Systém elektrolýzy nevyhnutne obsahuje kladný (anóda) a záporný (katóda) elektródy. Keď sa použije jednosmerný elektrický prúd, katióny sa pohybujú smerom ku katóde a anióny smerom k anóde. Katiónmi sú najmä ióny kovov a vodík a aniónmi kyslík a chlór. Na katóde si katióny pripájajú prebytočné elektróny, čím umožňujú redukčnú reakciu Men+ + ne → Me (kde n je valencia kovu). Naopak, na anóde sa elektróny z aniónu odovzdávajú späť, pričom prebieha oxidačná reakcia.
Tým je v systéme zabezpečený redoxný proces. Dôležité však je, že tento proces si vyžaduje energiu. Ten musí byť zabezpečený externým zdrojom prúdu.
Faradayove zákony elektrolýzy
Veľký fyzik M. Faraday svojím výskumom umožnil nielen pochopiť podstatu elektrolýzy, ale aj vykonať výpočty potrebné na jej realizáciu. V roku 1832 sa objavili jeho zákony, ktoré spájali hlavné parametre prebiehajúcich procesov.
Prvý zákon
Prvý Faradayov zákon hovorí, že hmotnosť látky redukovanej na anóde je priamo úmerná elektrickému náboju indukovanému v elektrolyte: m = kq = k*I*t, kde q je náboj, k je koeficient alebo elektrochemický ekvivalent látky, I je prúd tečúci elektrolytom, t je čas toku prúdu.

Druhý zákon
Faradayov druhý zákon umožnil určiť koeficient proporcionality k. Znie takto: elektrochemický ekvivalent akejkoľvek látky je priamo úmerný jej molárnej hmotnosti a nepriamo úmerný jej valencii. Zákon je vyjadrený v tvare:

k = 1/F*A/zkde F je Faradayova konštanta, A je molárna hmotnosť látky, z je jej chemická valencia.
Po zohľadnení oboch zákonov môžeme odvodiť konečný vzorec na výpočet hmotnosti látky usadenej na elektróde: m = A*I*t/(n*F)kde n je počet elektrónov zapojených do elektrolýzy. Zvyčajne n zodpovedá náboju iónu. Z praktického hľadiska je dôležité, aby sa hmotnosť látky vzťahovala na použitý prúd, čo umožňuje riadiť proces zmenou jeho sily.
Elektrolýza tavenín
Jedným z variantov elektrolýzy je použitie taveniny ako elektrolytu. V tomto prípade sa na elektrolytickom procese zúčastňujú len ióny taveniny. Klasickým príkladom je elektrolýza roztavenej soli NaCl (kuchynská soľ). Záporné ióny prúdia k anóde, čo znamená, že sa uvoľňuje plyn (Cl). Na katóde dôjde k redukcii kovu, t. j. k usadzovaniu čistého Na, ktorý vzniká z kladných iónov, ktoré prilákali prebytočné elektróny. Podobným spôsobom sa dajú vyrobiť aj iné kovy (K, Ca, Li atď.) z rozpúšťania príslušných solí.
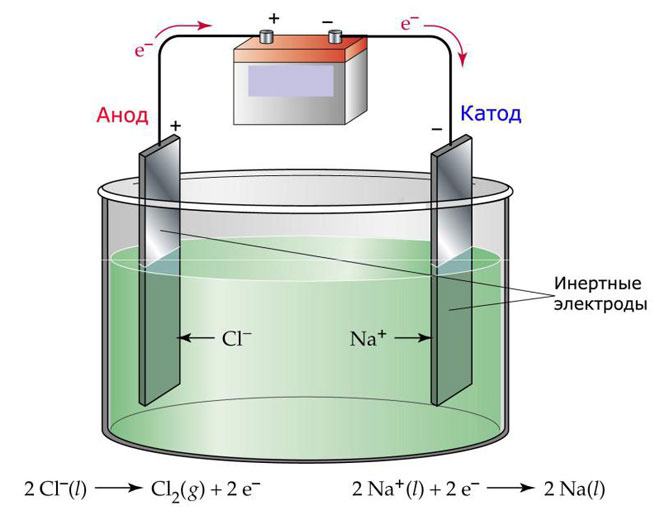
Pri roztavenej elektrolýze sa elektródy nerozpúšťajú, ale slúžia len ako zdroj prúdu. Pri ich výrobe sa môže použiť kov, grafit a niektoré polovodiče. Je dôležité, aby mal materiál dostatočnú vodivosť. Jedným z najbežnejších materiálov je meď.
Vlastnosti elektrolýzy v roztokoch
Elektrolýza vo vodnom roztoku je úplne odlišná od elektrolýzy v tavenine. Prebiehajú tu 3 konkurenčné procesy: oxidácia vody za vzniku kyslíka, oxidácia aniónu a anodické rozpúšťanie kovu. Proces zahŕňa vodné ióny, elektrolyt a anódu. V súlade s tým môže na katóde prebiehať redukcia vodíka, katiónov elektrolytu a anódového kovu.

Možnosť výskytu týchto konkurenčných procesov závisí od elektrického potenciálu systému. Uskutoční sa len ten proces, ktorý si vyžaduje menej vonkajšej energie. Preto sa katióny s najvyšším elektródovým potenciálom budú redukovať na katóde a anióny s najnižším potenciálom sa budú oxidovať na anóde. Elektródový potenciál vodíka sa považuje za "0". Napríklad v draslíku sa rovná (-2,93 В), sodík je (-2,71 В), olovo (-0,13 В) a pre striebro je to (+0,8 В).
Elektrolýza v plynoch
Plyn môže pôsobiť ako elektrolyt len vtedy, ak je prítomný ionizátor. V tomto prípade prúd tečie cez ionizované médium a spôsobuje potrebné procesy na elektródach. Faradayove zákony neplatia pre elektrolýzu plynu. Takéto podmienky sú nevyhnutné na jeho realizáciu:
- Bez umelej ionizácie plynu nepomôže ani vysoké napätie, ani vysoký prúd.
- Na elektrolýzu sú vhodné len plynné kyseliny bez obsahu kyslíka a niektoré plyny.
Dôležité! Proces prebieha podobne ako elektrolýza v kvapalnom elektrolyte, ak sú splnené potrebné podmienky.
Vlastnosti procesov prebiehajúcich na katóde a anóde
Pre praktické využitie elektrolýzy je dôležité pochopiť, čo sa deje na oboch elektródach pri použití elektrického prúdu. Charakteristické sú tieto procesy:
- Katóda. Kladne nabité ióny sa k nemu rútia. Tu dochádza k redukcii kovov alebo uvoľňovaniu vodíka. Podľa katiónovej aktivity možno rozlíšiť niekoľko kategórií kovov. Kovy ako Li, K, Ba, St, Ca, Na, Mg, Be, Al sa dobre redukujú len z roztavených solí. Ak sa použije roztok, vodík sa uvoľňuje elektrolýzou vody. Nasledujúce kovy sa dajú získať v roztoku, ale pri dostatočnej koncentrácii katiónov - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Tento proces je najjednoduchší pre Ag, Cu, Bi, Pt, Au, Hg.
- Anóda. Na túto elektródu sa privádzajú záporne nabité ióny. Pri oxidácii odoberajú kovu elektróny, čo vedie k ich anodickému rozpúšťaniu, t. j. Anióny sa premenia na kladne nabité ióny, ktoré smerujú ku katóde. Anióny sa tiež delia podľa svojej aktivity. Z taveniny sa môžu uvoľňovať len anióny PO4, CO3, SO4, NO3, NO2, ClO4, F. Vo vodných roztokoch nepodliehajú elektrolýze, ale vode s uvoľňovaním kyslíka. Najľahšie reagujú anióny ako OH, Cl, I, S a Br.

Pri elektrolýze je dôležité zohľadniť tendenciu materiálu elektródy oxidovať. Rozlišujú sa inertné a aktívne anódy. Inertné elektródy sú vyrobené z grafitu, uhlíka alebo platiny a nepodieľajú sa na prívode iónov.
Faktory ovplyvňujúce proces elektrolýzy
Proces elektrolýzy závisí od týchto faktorov
- Zloženie elektrolytu. Významný vplyv majú rôzne nečistoty. Tie sa delia na 3 typy - katióny, anióny a organické látky. Látky môžu byť viac alebo menej negatívne ako základný kov, čo narúša proces. Medzi organické nečistoty patria znečisťujúce látky (napr. oleje) a povrchovo aktívne látky. Ich koncentrácie sú na maximálnych povolených hodnotách.
- Hustota prúdu. V súlade s Faradayovým zákonom sa hmotnosť usadenej látky zvyšuje so silou prúdu. Vznikajú však nepriaznivé okolnosti - koncentrovaná polarizácia, zvýšené napätie, intenzívne zahrievanie elektrolytu. Vzhľadom na to existujú v každom prípade optimálne hodnoty prúdovej hustoty.
- pH elektrolytov. Kyslosť média sa tiež vyberá s ohľadom na kovy. Napríklad optimálne pH pre zinok je 140 g/cc.
- Teplota elektrolytu. To má nejednoznačný účinok. So zvyšujúcou sa teplotou sa zvyšuje rýchlosť elektrolýzy, ale aj aktivita nečistôt. Pre každý proces existuje optimálna teplota. Zvyčajne sa pohybuje medzi 38 a 45 stupňami.
Dôležité! Elektrolýzu možno urýchliť alebo spomaliť rôznymi vplyvmi a výberom zloženia elektrolytu. Pre každú aplikáciu platí iný režim, ktorý sa musí prísne dodržiavať.
Kde sa elektrolýza používa?
Elektrolýza sa používa v mnohých aplikáciách. Existuje niekoľko hlavných spôsobov použitia, ktoré sa dajú rozlíšiť podľa praktických výsledkov.
Galvanické pokovovanie
Elektrolýzou možno nanášať tenké, odolné galvanické kovové povlaky. Potiahnutý predmet sa umiestni do kúpeľa ako katóda a elektrolyt obsahuje soľ požadovaného kovu. Takto môžete pokryť oceľ zinkom, chrómom alebo cínom.

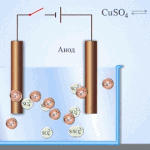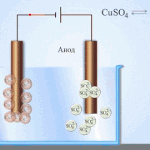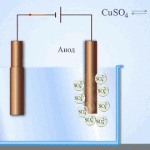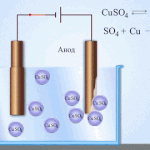
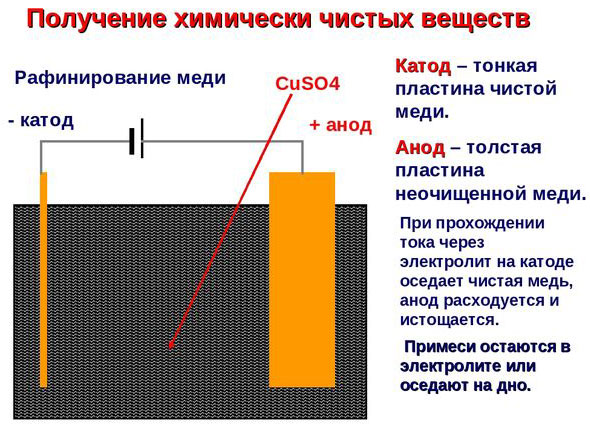
Elektrorafinácia - rafinácia medi
Príkladom procesu elektroúpravy je katóda - čistá meď anóda - meď s nečistotami, elektrolyt - vodný roztok síranu meďnatého. Meď z anódy sa mení na ióny a usadzuje sa v katóde bez akýchkoľvek nečistôt.
Extrakcia kovov
Na extrakciu kovov zo solí sa kovy roztavia a potom sa v tavenine elektrolyzujú. Tento proces je pomerne účinný pri získavaní hliníka z bauxitu, sodíka a draslíka.

Eloxovanie
Pri tomto procese sa povlak vyrába z nekovových zlúčenín. Klasickým príkladom je eloxovanie hliníka. Hliníková časť je namontovaná ako anóda. Elektrolytom je roztok kyseliny sírovej. V dôsledku elektrolýzy sa na anóde usadzuje vrstva oxidu hlinitého, ktorá má ochranné a dekoratívne vlastnosti. Uvedené technológie sa široko používajú v rôznych priemyselných odvetviach. Procesy je možné vykonávať aj vlastnými rukami a bezpečným spôsobom.
Náklady na energiu
Elektrolýza si vyžaduje veľké množstvo energie. Tento proces má praktický význam, ak je anodický prúd dostatočný, čo si vyžaduje, aby sa zo zdroja energie privádzal značný jednosmerný prúd. Okrem toho vznikajú bočné straty napätia - anodické a katodické prepätia a straty v elektrolyte v dôsledku jeho odporu. Účinnosť zariadenia sa určuje pomerom výkonu dodanej energie k jednotke užitočnej hmotnosti získanej látky.
Elektrolýza sa už dlho používa v priemysle s vysokou účinnosťou. Eloxovanie a galvanické pokovovanie sa stali bežnou súčasťou každodenného života a ťažba a spracovanie materiálov pomáha získavať mnohé kovy z rúd. Tento proces možno naplánovať a vypočítať, ak poznáme jeho základné zákonitosti.
Súvisiace články: