Často je problém rozhodnúť, ktorá elektróda je katódou a ktorá anódou. Dobrým začiatkom je porozumieť pojmom.
Obsah
Pojem katóda a anóda - jednoduché vysvetlenie
V zložitých látkach nie sú elektróny medzi atómami v zlúčeninách rozdelené rovnomerne. Interakcia spôsobuje pohyb častíc z atómu jednej látky do atómu inej látky. Táto reakcia sa nazýva oxidačno-redukčná reakcia. Strata elektrónov sa nazýva oxidácia, prvok, ktorý odovzdáva elektróny, sa nazýva redukčné činidlo.
Pridávanie elektrónov sa nazýva redukcia, prvok, ktorý prijíma elektróny, sa nazýva okysličovadlo. Prenos elektrónov z redukčného činidla na oxidačné činidlo sa môže uskutočniť prostredníctvom vonkajšieho obvodu a potom sa môže použiť ako zdroj elektrickej energie. Zariadenia, ktoré premieňajú energiu chemickej reakcie na elektrickú energiu, sa nazývajú galvanické články.
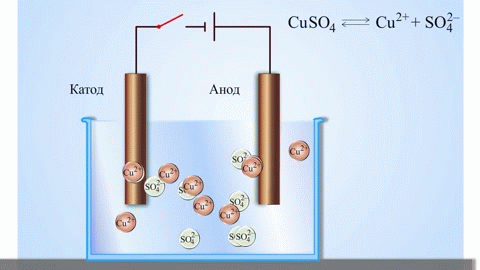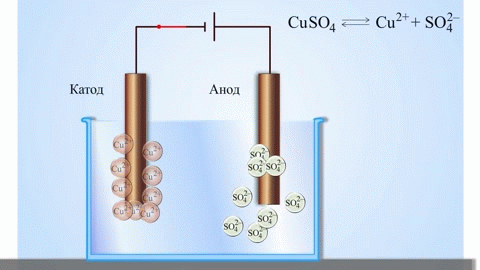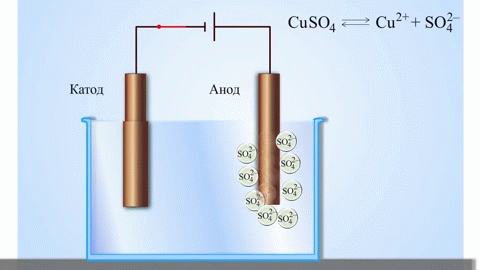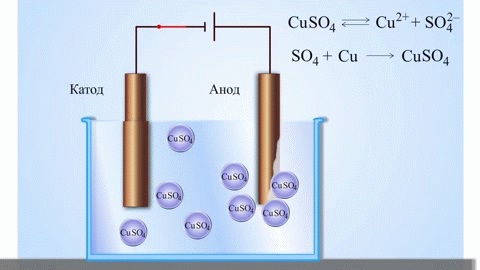
Najjednoduchším klasickým príkladom galvanického článku sú dve dosky z rôznych kovov ponorené do roztoku elektrolytu. V tomto systéme prebieha oxidácia na jednom kove a redukcia na druhom.
DÔLEŽITÉ! Elektróda, na ktorej prebieha oxidácia, sa nazýva anóda. Elektróda, na ktorej prebieha redukcia, sa nazýva katóda.
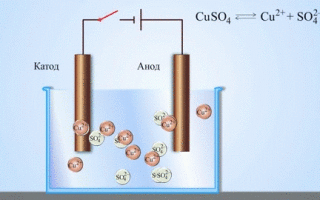
Galvanický článok meď-zinok, ktorý funguje na základe absorpcie energie reakcie medzi zinkom a síranom meďnatým, je známy príklad zo školských učebníc chémie. V Jacobyho-Danielovom zariadení je medená platňa umiestnená v roztoku síranu meďnatého (medená elektróda) a zinková platňa je ponorená v roztoku síranu zinočnatého (zinková elektróda). Zinková elektróda vylučuje katióny do roztoku, čím v ňom vytvára prebytok kladného náboja, zatiaľ čo na medenej elektróde je roztok ochudobnený o katióny, roztok je tu nabitý záporne.
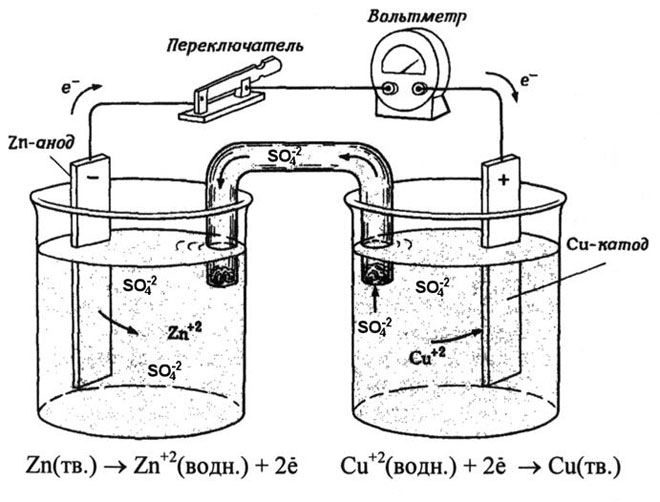
Uzavretie vonkajšieho obvodu spôsobí tok elektrónov zo zinkovej elektródy na medenú elektródu. Rovnovážne vzťahy na fázových hraniciach sú prerušené. Prebieha redoxná reakcia.
Energia spontánnej chemickej reakcie sa mení na elektrickú energiu.
Ak je chemická reakcia vyvolaná vonkajšou elektrickou energiou, nastáva proces nazývaný elektrolýza. Procesy prebiehajúce počas elektrolýzy sú opačné ako procesy prebiehajúce počas prevádzky galvanického článku.
POZOR! Elektróda, na ktorej prebieha redukcia, sa tiež nazýva katóda, ale pri elektrolýze je záporne nabitá a anóda je kladne nabitá.
Elektrochemické aplikácie
Anódy a katódy sa zúčastňujú na mnohých chemických reakciách:
- Elektrolýza;
- Elektroextrakcia;
- Galvanické pokovovanie;
- Galvanické pokovovanie.
Elektrolýzou roztavených zlúčenín a vodných roztokov sa získavajú kovy, čistia sa od nečistôt a získavajú sa cenné zložky (elektrolytická rafinácia). Dosky sa odlievajú z kovu, ktorý sa má zušľachtiť. Dosky sú v elektrolyzéri umiestnené ako anódy. Kov sa rozpúšťa elektrickým prúdom. Jeho katióny prechádzajú do roztoku a odvádzajú sa na katóde, pričom sa vytvára zrazenina čistého kovu. Nečistoty obsiahnuté v pôvodnej surovej kovovej doske buď zostávajú nerozpustné ako anódový kal, alebo prechádzajú do elektrolytu, kde sa odstraňujú. Meď, nikel, olovo, zlato, striebro a cín sa podrobujú elektrolytickej rafinácii.
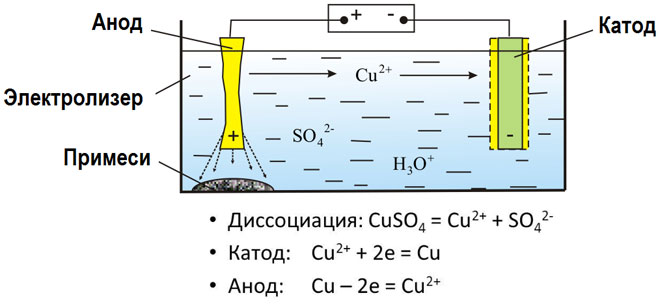
Elektroextrakcia je proces extrakcie kovu z roztoku počas elektrolýzy. Aby sa kov preniesol do roztoku, spracuje sa špeciálnymi činidlami. Pri tomto procese sa na katóde oddeľuje kov vysokej čistoty. Takto sa vyrába zinok, meď a kadmium.
Aby sa zabránilo korózii, výrobok bol pevnejší a dekoratívnejší, povrch jedného kovu je potiahnutý iným. Tento proces sa nazýva galvanizácia.

Elektroformovanie je proces výroby kovových kópií trojrozmerných predmetov elektrolytickým nanášaním kovu.

Vákuové elektronické aplikácie
Princíp katódy a anódy vo vákuovom prístroji možno demonštrovať pomocou elektrónky. Vyzerá ako hermeticky uzavretá nádoba s kovovými časťami vo vnútri. Zariadenie sa používa na usmerňovanie, generovanie a konverziu elektrických signálov. Rozlišuje sa podľa počtu elektród:
- diódy;
- triódy;
- tetródy;
- pentódy atď.
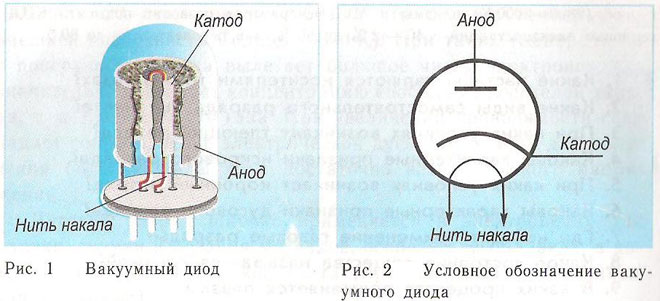
Dióda je vákuové zariadenie s dvoma elektródami, katódou a anódou. Katóda je pripojená k zápornému pólu zdroja a anóda ku kladnému pólu. Účelom katódy je emitovať elektróny, keď sa zahreje elektrickým prúdom na určitú teplotu. Elektróny sa používajú na vytvorenie priestorového náboja medzi katódou a anódou. Najrýchlejšie elektróny sa rútia smerom k anóde a prekonávajú zápornú potenciálovú bariéru priestorového náboja. Anóda prijíma častice. Vo vonkajšom obvode sa vytvára anodický prúd. Tok elektrónov sa riadi pomocou ďalších elektród, ktoré sú napájané elektrickým potenciálom. Diódy sa používajú na premenu striedavého prúdu na jednosmerný.
Aplikácie v elektronike
Dnes sa používajú polovodičové typy diód.
Vlastnosť diód prepúšťať prúd v priamom smere a neprepúšťať prúd v opačnom smere sa v elektronike široko využíva.
Činnosť LED je založená na vlastnosti polovodičových kryštálov svietiť, keď cez p-n prechod prechádza prúd v priamom smere.
Galvanické zdroje jednosmerného prúdu - batérie
Chemické zdroje elektrického prúdu, v ktorých prebiehajú vratné reakcie, sa nazývajú akumulátory: dobíjajú sa a používajú opakovane.

Pri práci oloveného akumulátora prebieha redoxná reakcia. Kovové olovo sa oxiduje a odovzdáva svoje elektróny, čím sa redukuje oxid olovnatý, ktorý prijíma elektróny. Kovové olovo v batérii je anóda a je záporne nabité. Oxid olovnatý je katóda a je kladne nabitý.
Pri vybíjaní batérie sa spotrebúvajú látky z katódy a anódy a ich elektrolyt, kyselina sírová. Ak chcete batériu nabiť, pripojte ju k zdroju prúdu (plus k plusu, mínus k mínusu). Smer prúdu je teraz opačný ako pri vybíjaní batérie. Elektrochemické procesy na elektródach sú "obrátené". Olovená elektróda sa teraz stáva katódou, kde prebieha redukčný proces, a oxid olovnatý sa stáva anódou, kde prebieha oxidačný proces. Látky potrebné pre batériu sa opäť vytvárajú v batérii.
Prečo dochádza k zmätku?
Problém vzniká preto, lebo určitý znak náboja nemožno pevne priradiť ani k anóde, ani ku katóde. Katóda je často kladne nabitá elektróda a anóda je záporná elektróda. Často, ale nie vždy. Všetko závisí od procesu, ktorý prebieha na elektróde.
VAROVANIE! Časť, ktorá bola umiestnená v elektrolyte, môže byť anódou aj katódou. Všetko závisí od účelu procesu: naniesť ďalšiu vrstvu kovu alebo odstrániť vrstvu kovu.
Ako identifikovať anódu a katódu
V elektrochémii je anóda elektróda, na ktorej prebiehajú oxidačné procesy, a katóda je elektróda, na ktorej prebieha redukcia.
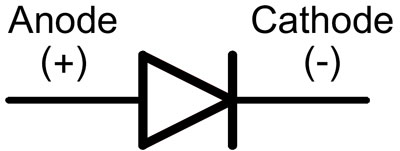
V dióde sa vývody nazývajú anóda a katóda. Prúd bude pretekať diódou, ak je anódový vodič pripojený k "plusu" a katódový vodič k "mínusu".
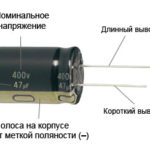
V prípade novej LED diódy s neorezanými kolíkmi sa anóda a katóda určujú vizuálne podľa dĺžky. Katóda je kratšia.

Ak sú kontakty prerezané, pomôže k nim pripojená batéria. Svetlo sa objaví, keď sa polarita zhoduje.
Znamienko anódy a katódy
V elektrochémii je správnejšie hovoriť o procesoch prebiehajúcich na elektródach namiesto o znakoch elektród. Redukčná reakcia prebieha na katóde a oxidačná reakcia prebieha na anóde.
V elektrotechnike je katóda pripojená k zápornému pólu zdroja prúdu a anóda ku kladnému pólu.
Súvisiace články: