どちらの電極が陰極でどちらが陽極かを判断することはしばしば問題になります。まず、用語を理解する必要があります。
コンテンツ
カソードとアノードの概念 - 簡単な説明
複雑な物質では、化合物の原子間の電子は均一に分布していません。相互作用の結果、粒子はある物質の原子から別の物質の原子に移動します。この反応をレドックス反応といいます。電子を失うことを酸化と呼び、電子を放出する元素を還元剤と呼びます。
電子の追加は還元と呼ばれます。このプロセスで電子を受け取る要素は酸化剤です。還元剤から酸化剤への電子の移動は、外部回路を通って流れることができ、電気エネルギー源として使用することができます。化学反応のエネルギーを電気エネルギーに変換するデバイスは、ガルバニ電池と呼ばれます。
ガルバニ電池の最も単純な古典的な例は、異なる金属でできており、電解液に浸された 2 つのプレートです。このようなシステムでは、一方の金属で酸化が起こり、もう一方の金属で還元が起こります。
重要! 酸化が起こる電極は陽極と呼ばれます。還元が起こる電極は陰極と呼ばれます。
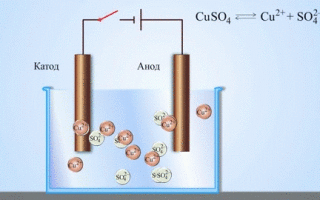
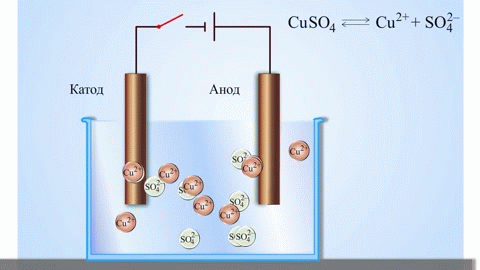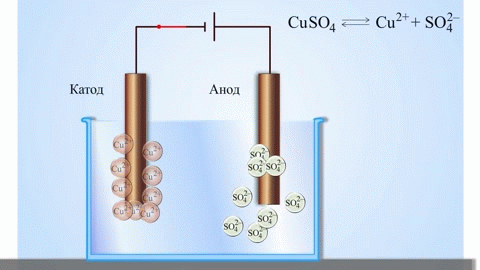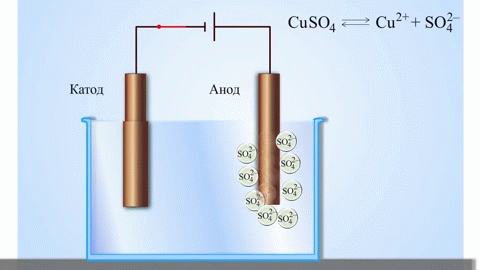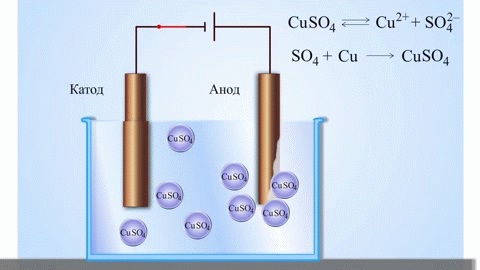
学校の化学の教科書から、亜鉛と硫酸銅の間の反応エネルギーによって機能する銅-亜鉛ガルバニ電池の例を知っています。 Jacoby-Daniel の装置では、銅板を硫酸銅溶液 (銅電極) に入れ、亜鉛板を硫酸亜鉛溶液 (亜鉛電極) に浸します。亜鉛電極は溶液に陽イオンを放出し、過剰な正電荷を生成しますが、銅電極では溶液から陽イオンが枯渇し、溶液は負に帯電します。
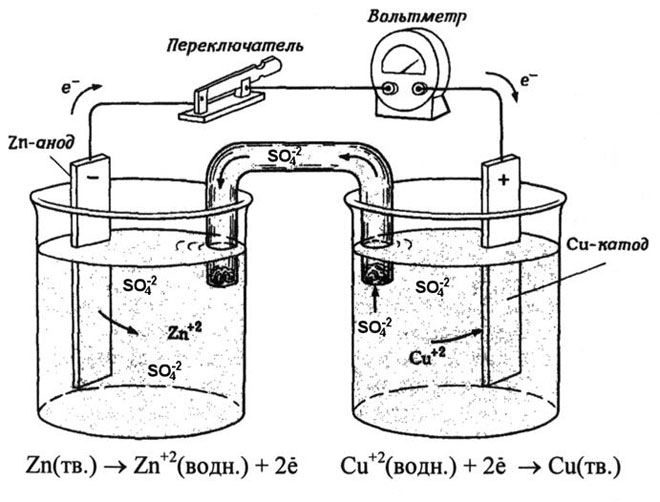
外部回路を閉じると、電子が亜鉛電極から銅電極に流れます。相境界での平衡関係は中断されます。レドックス反応が起こります。
自発的な化学反応のエネルギーが電気エネルギーに変わります。
化学反応が電流の外部エネルギーによって引き起こされる場合、電気分解と呼ばれるプロセスがあります。電気分解に含まれるプロセスは、ガルバニ電池の動作に含まれるプロセスの逆です。
警告。 還元が行われる電極は陰極とも呼ばれますが、電気分解ではマイナスに帯電し、陽極はプラスに帯電します。
電気化学アプリケーション
陽極と陰極は、多くの化学反応に関与しています。
- 電解;
- 電気抽出;
- 電気めっき;
- 電気めっき。
溶融化合物と水溶液の電気分解は、金属を生成し、不純物から金属を精製し、貴重な成分を抽出します (電解精製)。プレートは金属から鋳造され、精錬されます。プレートは、電解槽の陽極として配置されます。金属は電流によって溶解されます。その陽イオンは溶液に入り、陰極で放出され、純粋な金属の沈殿物を形成します。元の粗金属プレートに含まれる不純物は、陽極スラッジの形で不溶性のままになるか、電解質に移行して除去されます。銅、ニッケル、鉛、金、銀、スズを電解精錬します。
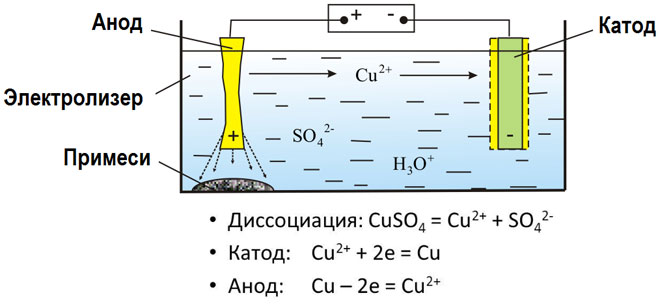
電気抽出は、電気分解中に溶液から金属を抽出するプロセスです。金属は特殊な試薬で処理され、溶液になります。プロセスの過程で、高純度を特徴とする金属がカソードで放出されます。これが亜鉛、銅、カドミウムの製造方法です。
腐食を防ぎ、強度を持たせ、製品を装飾するために、ある金属の表面が別の層で覆われています。このプロセスは電気メッキと呼ばれます。

電気めっきは、金属の電着によって 3 次元オブジェクトの金属コピーを作成するプロセスです。

真空電子機器での使用
真空装置におけるカソードとアノードの原理は、電子管で実証できます。内部に金属部品が入った密閉容器のように見えます。このデバイスは、電気信号の整流、生成、および変換に使用されます。電極の数に応じて区別されます。
- ダイオード;
- 三極管;
- テトロード;
- 五極管など
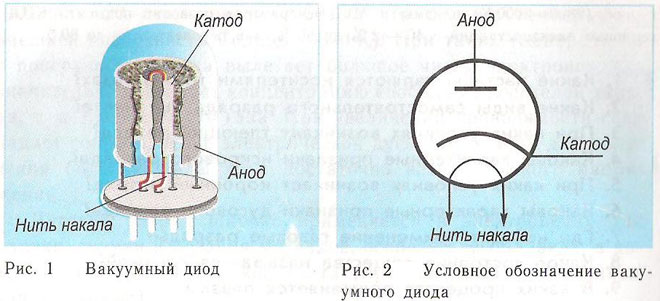
ダイオードは、カソードとアノードの 2 つの電極を備えた真空デバイスです。カソードは電源の負極に接続され、アノードは正極に接続されます。カソードの目的は、電流加熱の影響下で特定の温度に電子を放出することです。放出された電子によって、カソードとアノードの間に空間電荷が生成されます。最速の電子がアノードに突入し、空間電荷の負の電位障壁を克服します。アノードはこれらの粒子を受け取ります。外部回路に陽極電流が発生します。電子の流れは、追加の電極に電位を加えることによって制御されます。ダイオードは、交流を直流に変換するために使用されます。
エレクトロニクス アプリケーション
現在、半導体タイプのダイオードが使用されています。
順方向に電流を通し、逆方向には電流を流さないというダイオードの特性は、電子機器で広く使用されています。
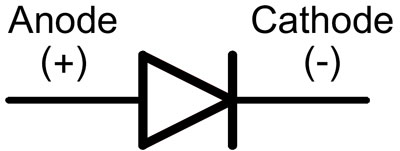
LED の動作は、電流が p-n 接合を順方向に通過するときに発光する半導体結晶の特性に基づいています。
直流電流源 - 蓄電池
可逆反応が起こる化学電流源は充電式電池と呼ばれ、充電して繰り返し使用されます。

鉛バッテリーが作動すると、酸化還元反応が起こります。金属鉛は酸化され、その電子を放棄し、電子を受け取る二酸化鉛を還元します。バッテリーの金属リードはアノードであり、負に帯電しています。二酸化鉛はカソードであり、正に帯電しています。
電池が放電すると、正極と負極の物質とそれらの電解質である硫酸が消費されます。バッテリーを充電するには、電流源に接続します(プラスからプラス、マイナスからマイナス)。電流の方向は、バッテリーが放電されたときとは逆になります。電極での電気化学プロセスは「逆」です。ここで、鉛電極がカソードになり、還元プロセスが行われ、二酸化鉛がアノードになり、酸化プロセスが行われます。電池が機能するために必要な物質は、電池の中で再び作られます。
なぜ混乱があるのですか?
問題は、電荷の特定の兆候が陽極または陰極にしっかりと付着できないために発生します。多くの場合、カソードは正に帯電した電極であり、アノードは負の電極です。多くの場合、常にではありません。それはすべて、電極で行われるプロセスに依存します。
警告。 電解質に入れる部分は、陽極と陰極の両方にすることができます。それはすべて、プロセスの目的に依存します。つまり、その上に別の金属層を配置するか、それを取り除くかです。
陽極と陰極の決め方
電気化学では、陽極は酸化プロセスが行われる電極であり、陰極は還元が行われる電極です。
ダイオードでは、リードはアノードとカソードと呼ばれます。 「アノード」リードが「プラス」に接続され、「カソード」リードが「マイナス」に接続されている場合、電流はダイオードを通って流れます。
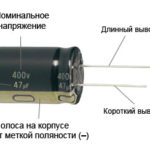
ピンが切断されていない新しい LED の場合、アノードとカソードは長さによって視覚的に決定されます。陰極が短い。

接点が切断されている場合は、それらに取り付けられたバッテリーが役立ちます。極性が一致すると光が現れます。
陽極と陰極のサイン
電気化学では、電極の電荷の兆候についてではなく、電極で進行中のプロセスについて話す方が正しいです。還元反応は陰極で起こり、酸化反応は陽極で起こります。
電気工学では、電流を流すために、カソードを電流源の負極に接続し、アノードを正極に接続します。
関連記事: