Pertanyaan tentang apa elektrolisis dibahas sejak kursus fisika sekolah menengah, dan bukan rahasia lagi bagi kebanyakan orang. Hal lain adalah pentingnya dan aplikasi praktis. Proses ini sangat bermanfaat di berbagai industri dan dapat bermanfaat bagi pengrajin rumah.
Isi
Apa itu elektrolisis?
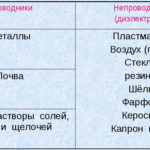
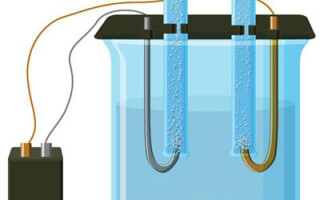
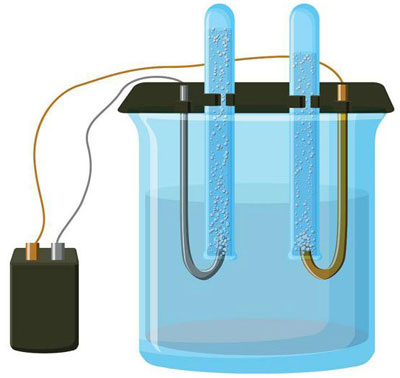
Elektrolisis adalah kompleks proses spesifik dalam sistem elektroda dan elektrolit ketika arus listrik langsung mengalir melaluinya. Mekanismenya didasarkan pada pembangkitan arus ionik. Elektrolit adalah konduktor tipe 2 (konduktivitas ionik) di mana disosiasi elektrolitik terjadi. Ini melibatkan dekomposisi menjadi ion dengan positif (kation) dan negatif (anion) mengenakan biaya.
Suatu sistem elektrolit harus mengandung positif (anoda) dan negatif (katoda) elektroda. Ketika arus listrik searah diterapkan, kation mulai bergerak menuju katoda dan anion bergerak menuju anoda.Kation terutama ion logam dan hidrogen, dan anion adalah oksigen dan klorin. Di katoda, kation menempelkan kelebihan elektron ke dirinya sendiri, memungkinkan reaksi reduksi Men+ + ne → Me (di mana n adalah valensi logam). Di anoda, sebaliknya, elektron dilepaskan dari anion dengan reaksi oksidatif yang terjadi.
Dengan demikian, proses redoks dipastikan dalam sistem. Penting untuk diingat bahwa agar hal itu terjadi, diperlukan energi yang sesuai. Itu harus disediakan oleh sumber arus eksternal.
Hukum Faraday tentang elektrolisis
Fisikawan besar M. Faraday, melalui penelitiannya, memungkinkan tidak hanya untuk memahami sifat elektrolisis, tetapi juga membuat perhitungan yang diperlukan untuk implementasinya. Pada tahun 1832 hukumnya muncul, menghubungkan parameter utama dari proses yang terjadi.
hukum pertama
Hukum pertama Faraday menyatakan bahwa massa zat yang direduksi pada anoda berbanding lurus dengan muatan listrik yang diinduksi dalam elektrolit: m = kq = k*I*t, di mana q adalah muatan, k adalah koefisien atau ekivalen elektrokimia dari zat, I adalah arus yang mengalir melalui elektrolit, t adalah waktu aliran arus.

Hukum kedua
Hukum kedua Faraday memungkinkan untuk menentukan koefisien proporsionalitas k. Bunyinya sebagai berikut: ekivalen elektrokimia suatu zat berbanding lurus dengan massa molarnya dan berbanding terbalik dengan valensinya. hukum dinyatakan sebagai:

k = 1/F*A/zdi mana F adalah konstanta Faraday, A adalah massa molar zat, z adalah valensi kimianya.
Dengan mempertimbangkan kedua hukum tersebut, kita dapat memperoleh rumus akhir untuk menghitung massa zat yang diendapkan pada elektroda: m = A*I*t/(n*F)di mana n adalah jumlah elektron yang terlibat dalam elektrolisis. Biasanya n sesuai dengan muatan ion.Dari sudut pandang praktis, penting untuk menghubungkan massa zat dengan arus yang disuplai, yang memungkinkan untuk mengontrol proses dengan mengubah kekuatannya.
Elektrolisis lelehan
Salah satu pilihan untuk elektrolisis adalah dengan menggunakan lelehan sebagai elektrolit. Dalam hal ini, hanya ion leleh yang terlibat dalam proses elektrolisis. Contoh klasik adalah elektrolisis garam lelehan NaCl (garam dapur). Ion negatif bergegas menuju anoda, yang berarti bahwa gas dilepaskan (Cl). Pada katoda akan terjadi reduksi logam, yaitu pengendapan Na murni yang terbentuk dari ion positif yang menarik elektron berlebih. Demikian pula, logam lain dapat diproduksi (K, Ca, Li, dll.) dari lelehan garam masing-masing.
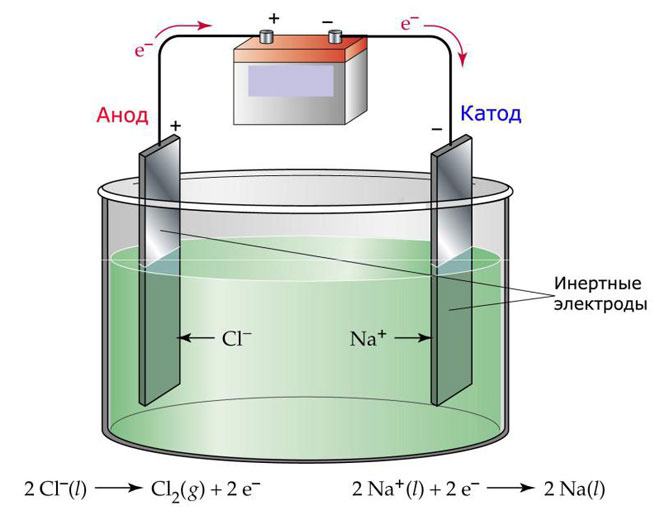
Selama elektrolisis dalam lelehan, elektroda tidak larut tetapi hanya berpartisipasi sebagai sumber arus. Logam, grafit, dan beberapa semikonduktor dapat digunakan dalam pembuatannya. Adalah penting bahwa bahan tersebut memiliki konduktivitas yang cukup. Salah satu bahan yang paling umum adalah tembaga.
Fitur elektrolisis dalam larutan
Elektrolisis dalam larutan berair sangat berbeda dari lelehan. Ada 3 proses bersaing: oksidasi air dengan pelepasan oksigen, oksidasi anion dan pembubaran anodik logam. Proses ini melibatkan ion air, elektrolit dan anoda. Dengan demikian, reduksi hidrogen, kation elektrolit, dan logam anoda dapat terjadi di katoda.

Kemampuan proses bersaing ini terjadi tergantung pada potensi listrik dari sistem. Hanya proses yang membutuhkan lebih sedikit energi eksternal yang akan dilanjutkan. Akibatnya, kation dengan potensial elektroda maksimum akan berkurang di katoda, dan anion dengan potensi terendah akan teroksidasi di anoda. Potensial elektroda hidrogen diambil sebagai "0". Misalnya, dalam kalium itu sama dengan (-2,93), natrium sama dengan (-2,71), memimpin (-0,13), dan untuk perak - (+0,8).
Elektrolisis dalam gas
Gas dapat melakukan peran elektrolit hanya dengan adanya ionizer. Dalam hal ini, arus yang melewati media terionisasi menyebabkan proses yang diperlukan pada elektroda. Hukum Faraday tidak berlaku untuk elektrolisis gas. Kondisi seperti itu diperlukan untuk realisasinya:
- Tanpa ionisasi buatan gas, baik tegangan tinggi maupun arus tinggi tidak akan membantu.
- Hanya asam bebas oksigen dalam bentuk gas dan beberapa gas yang cocok untuk elektrolisis.
Penting! Jika kondisi yang diperlukan terpenuhi, proses berlangsung mirip dengan elektrolisis dalam elektrolit cair.
Keunikan proses yang terjadi pada katoda dan anoda
Untuk aplikasi praktis elektrolisis, penting untuk memahami apa yang terjadi pada kedua elektroda ketika arus listrik diterapkan. Proses berikut adalah karakteristiknya:
- Katoda. Ion bermuatan positif bergegas ke arahnya. Di sinilah reduksi logam atau pelepasan hidrogen terjadi. Beberapa kategori logam dapat dibedakan menurut aktivitas kationiknya. Logam seperti Li, K, Ba, St, Ca, Na, Mg, Be, Al tereduksi dengan baik hanya dari garam cair. Jika larutan digunakan, hidrogen dilepaskan karena elektrolisis air. Dimungkinkan untuk memberikan reduksi dalam larutan, tetapi dengan konsentrasi kation yang cukup, dalam logam berikut - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Proses yang paling mudah untuk Ag, Cu, Bi, Pt, Au, Hg.
- Anoda. Ion bermuatan negatif tiba di elektroda ini. Mengoksidasi mereka, mereka mengambil elektron dari logam, yang mengarah ke pembubaran anodik mereka, yaitu anion diubah menjadi ion bermuatan positif, yang diarahkan ke katoda. Anion juga dibagi menurut aktivitasnya. Hanya anion PO4, CO3, SO4, NO3, NO2, ClO4, F yang dapat dilepaskan dari lelehan. Dalam larutan berair, mereka tidak mengalami elektrolisis, tetapi air dengan pelepasan oksigen. Anion seperti OH, Cl, I, S, Br paling mudah bereaksi.

Saat memberikan elektrolisis, penting untuk mempertimbangkan kecenderungan bahan elektroda untuk teroksidasi. Dalam hal ini, anoda inert dan aktif dibedakan. Elektroda inert terbuat dari grafit, batu bara atau platinum dan tidak terlibat dalam penyediaan ion.
Faktor-faktor yang mempengaruhi proses elektrolisis
Proses elektrolisis tergantung pada faktor-faktor berikut:
- Komposisi elektrolit. Pengaruh signifikan diberikan oleh berbagai pengotor. Mereka dibagi menjadi 3 jenis - kation, anion dan organik. Zat bisa lebih atau kurang negatif dari logam dasar, yang mengganggu proses. Di antara pengotor organik adalah kontaminan (misalnya minyak) dan surfaktan. Konsentrasi mereka memiliki nilai batas.
- Kepadatan arus. Menurut hukum Faraday, massa zat yang disimpan meningkat dengan meningkatnya kekuatan arus. Namun, keadaan yang tidak menguntungkan muncul - polarisasi terkonsentrasi, peningkatan tegangan, pemanasan elektrolit yang intens. Dengan pemikiran ini, ada nilai kepadatan arus yang optimal untuk setiap kasus.
- pH elektrolit. Keasaman medium juga dipilih dengan mempertimbangkan logam. Misalnya, nilai keasaman elektrolit yang optimum untuk seng adalah 140 g/cc.
- Suhu elektrolit. Ini memiliki efek ambigu. Dengan meningkatnya suhu, laju elektrolisis meningkat, tetapi begitu juga aktivitas pengotor. Ada suhu optimal untuk setiap proses. Biasanya antara 38-45 derajat.
Penting! Elektrolisis dapat dipercepat atau diperlambat oleh pengaruh yang berbeda dan pilihan komposisi elektrolit. Setiap aplikasi memiliki modenya sendiri, yang harus diperhatikan dengan ketat.
Di mana elektrolisis digunakan?
Elektrolisis digunakan dalam banyak aplikasi. Beberapa kegunaan utama dapat diidentifikasi untuk hasil praktis.
Elektroplating
Lapisan logam galvanik yang tipis dan tahan lama dapat diterapkan dengan elektrolisis.Item yang akan dilapisi ditempatkan di bak mandi sebagai katoda, dan elektrolit mengandung garam dari logam yang diinginkan. Ini adalah bagaimana baja dapat dilapisi dengan seng, kromium atau timah.

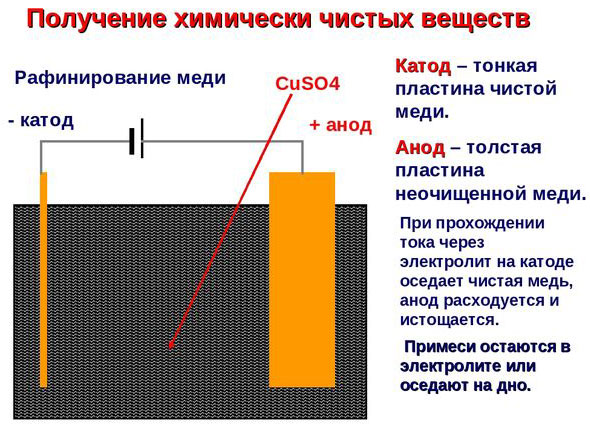
Electrotreatment - pemurnian tembaga
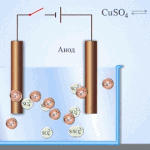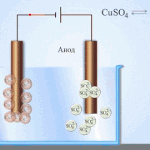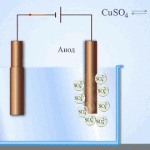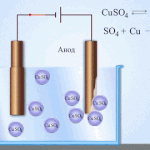
Contoh pemurnian listrik adalah opsi ini: katoda - tembaga murni, anoda - tembaga dengan kotoran, elektrolit - larutan tembaga sulfat dalam air. Tembaga dari anoda berubah menjadi ion dan disimpan di katoda tanpa pengotor.
Ekstraksi logam.
Untuk mendapatkan logam dari garam, mereka dipindahkan ke dalam lelehan dan kemudian elektrolisis disediakan di dalamnya. Cara ini cukup efektif untuk memperoleh aluminium dari bauksit, natrium, dan kalium.

Anodisasi
Dalam proses ini, pelapis dibuat dari senyawa non-logam. Contoh klasik adalah anodizing aluminium. Bagian aluminium dipasang seperti anoda. Elektrolitnya adalah larutan asam sulfat. Sebagai hasil dari elektrolisis, lapisan aluminium oksida diendapkan pada anoda, yang memiliki sifat pelindung dan dekoratif. Teknologi ini banyak digunakan di berbagai industri. Dimungkinkan juga untuk melakukan proses dengan tangan Anda sendiri dengan cara yang aman.
Biaya energi
Elektrolisis membutuhkan banyak energi. Proses ini akan bernilai praktis jika arus anodik mencukupi, dan untuk ini perlu diterapkan arus searah yang cukup besar dari sumber tenaga listrik. Selain itu, ia menghasilkan kerugian tegangan samping - tegangan lebih anodik dan katodik, kerugian dalam elektrolit karena hambatannya. Efisiensi pembangkit ditentukan dengan menghubungkan daya masukan energi dengan satuan massa yang berguna dari zat yang diperoleh.
Elektrolisis telah lama digunakan dalam industri dengan efisiensi tinggi. Anodizing dan elektroplating telah menjadi hal biasa dalam kehidupan sehari-hari, dan penambangan dan pemanfaatan material membantu mengekstraksi banyak logam dari bijih.Proses tersebut dapat direncanakan dan diperhitungkan dengan mengetahui pola dasarnya.
Artikel terkait: