Seringkali menjadi masalah untuk menentukan elektroda mana yang merupakan katoda dan mana yang merupakan anoda. Untuk memulainya, kita perlu memahami istilah-istilahnya.
Isi
Konsep katoda dan anoda - penjelasan sederhana
Pada zat kompleks, elektron antar atom dalam senyawa tidak terdistribusi secara merata. Sebagai hasil interaksi, partikel-partikel berpindah dari atom suatu zat ke atom zat lain. Reaksi tersebut disebut reaksi redoks. Hilangnya elektron disebut oksidasi, unsur yang melepaskan elektron disebut reduktor.
Penambahan elektron disebut reduksi; unsur yang mengambil elektron dalam proses ini adalah oksidator. Perpindahan elektron dari zat pereduksi ke zat pengoksidasi dapat mengalir melalui rangkaian eksternal, dan kemudian dapat digunakan sebagai sumber energi listrik. Perangkat di mana energi reaksi kimia diubah menjadi energi listrik disebut sel galvanik.
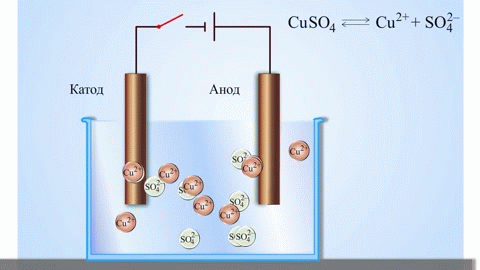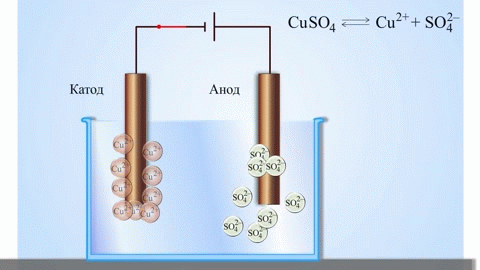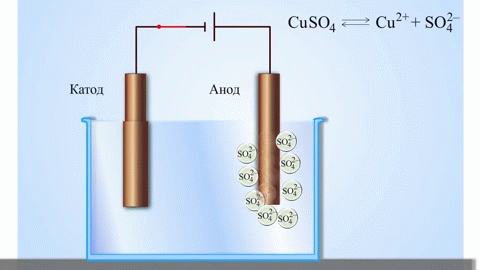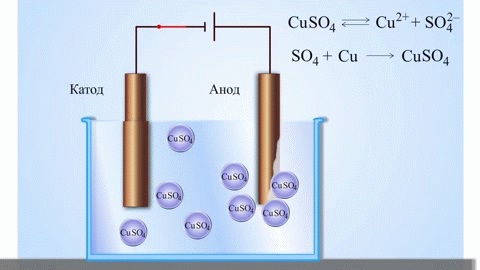
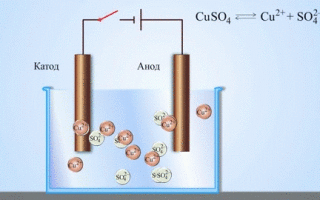
Contoh klasik paling sederhana dari sel galvanik adalah dua pelat yang terbuat dari logam yang berbeda dan direndam dalam larutan elektrolit.Dalam sistem seperti itu, oksidasi terjadi pada satu logam dan reduksi terjadi pada logam lainnya.
PENTING! Elektroda tempat terjadinya oksidasi disebut anoda. Elektroda tempat terjadinya reduksi disebut katoda.
Dari buku teks kimia sekolah kita mengetahui contoh sel galvanik tembaga-seng, yang bekerja karena energi reaksi antara seng dan tembaga sulfat. Pada alat Jacoby-Daniel, pelat tembaga dicelupkan ke dalam larutan tembaga sulfat (elektroda tembaga), dan pelat seng dicelupkan ke dalam larutan seng sulfat (elektroda seng). Elektroda seng melepaskan kation ke dalam larutan, menciptakan muatan positif berlebih di dalamnya, sedangkan pada elektroda tembaga larutan kehabisan kation, di sini larutan bermuatan negatif.
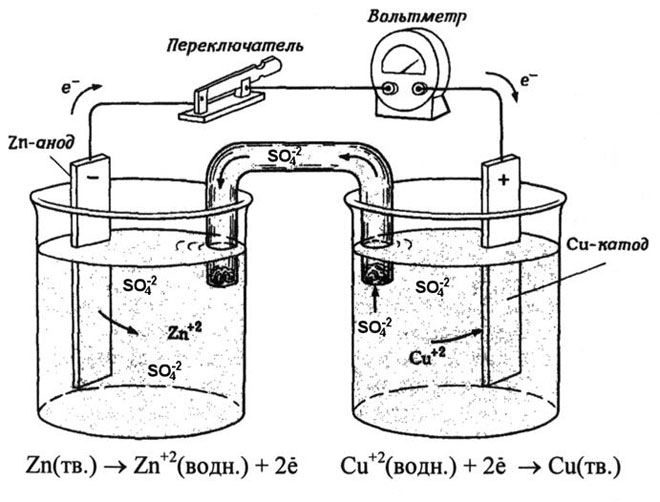
Penutupan sirkuit eksternal menyebabkan elektron mengalir dari elektroda seng ke elektroda tembaga. Hubungan kesetimbangan pada batas fasa terputus. Reaksi redoks berlangsung.
Energi reaksi kimia spontan berubah menjadi energi listrik.
Jika reaksi kimia dipicu oleh energi eksternal arus listrik, ada proses yang disebut elektrolisis. Proses yang terlibat dalam elektrolisis adalah kebalikan dari proses yang terlibat dalam pengoperasian sel galvanik.
PERINGATAN. Elektroda tempat terjadinya reduksi disebut juga katoda, tetapi dalam elektrolisis bermuatan negatif dan anoda bermuatan positif.
Aplikasi Elektrokimia
Anoda dan katoda mengambil bagian dalam banyak reaksi kimia:
- Elektrolisa;
- Ekstraksi elektro;
- elektroplating;
- Elektroplating.
Elektrolisis senyawa cair dan larutan berair menghasilkan logam, memurnikan logam dari pengotor dan mengekstrak komponen berharga (pemurnian elektrolit). Pelat dilemparkan dari logam untuk dimurnikan. Pelat ditempatkan sebagai anoda dalam elektroliser. Logam dilarutkan oleh arus listrik.Kationnya masuk ke dalam larutan dan dibuang di katoda, membentuk endapan logam murni. Kotoran yang terkandung dalam pelat logam mentah asli tetap tidak larut dalam bentuk lumpur anodik atau masuk ke elektrolit, dari mana mereka dihilangkan. Tembaga, nikel, timah, emas, perak dan timah mengalami pemurnian elektrolitik.
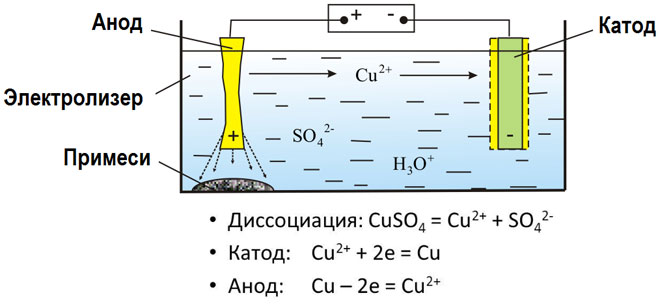
Elektroekstraksi adalah proses ekstraksi logam dari larutan selama elektrolisis. Logam diperlakukan dengan reagen khusus untuk membuatnya masuk ke dalam larutan. Selama proses, logam yang dicirikan dengan kemurnian tinggi dilepaskan di katoda. Ini adalah bagaimana seng, tembaga, dan kadmium diproduksi.
Untuk menghindari korosi, memberi kekuatan, dan menghias produk, permukaan satu logam ditutupi dengan lapisan lain. Proses ini disebut elektroplating.

Elektroplating adalah proses membuat salinan logam dari benda tiga dimensi dengan elektro-deposisi logam.

Gunakan dalam perangkat elektronik vakum
Prinsip katoda dan anoda dalam peralatan vakum dapat ditunjukkan oleh tabung elektron. Itu terlihat seperti bejana yang tertutup rapat dengan bagian logam di dalamnya. Perangkat ini digunakan untuk memperbaiki, menghasilkan, dan mengubah sinyal listrik. Menurut jumlah elektroda dibedakan:
- dioda;
- triode;
- tetroda;
- pentode, dll.
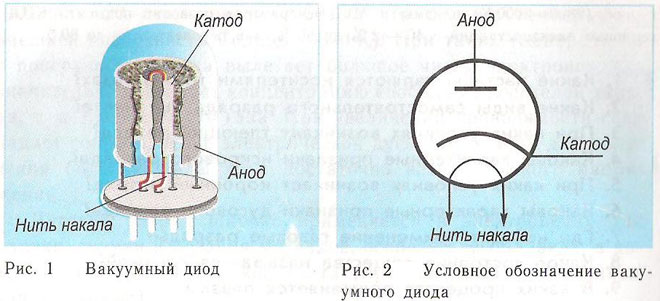
Dioda adalah perangkat vakum dengan dua elektroda, katoda dan anoda. Katoda terhubung ke kutub negatif dari catu daya, anoda ke kutub positif. Tujuan katoda adalah untuk memancarkan elektron di bawah pengaruh pemanasan arus listrik hingga suhu tertentu. Melalui elektron yang dipancarkan, muatan spasial dibuat antara katoda dan anoda. Elektron tercepat bergegas ke anoda, mengatasi penghalang potensial negatif dari muatan ruang. Anoda menerima partikel-partikel ini. Arus anodik di sirkuit eksternal dibuat.Aliran elektron dikendalikan melalui elektroda tambahan dengan menerapkan potensi listrik kepada mereka. Dioda digunakan untuk mengubah arus bolak-balik menjadi arus searah.
Aplikasi elektronik
Saat ini, jenis dioda semikonduktor digunakan.
Sifat dioda untuk melewatkan arus dalam arah maju dan tidak melewatkan arus dalam arah sebaliknya banyak digunakan dalam elektronika.
Operasi LED didasarkan pada sifat kristal semikonduktor untuk bersinar ketika arus melewati sambungan p-n dalam arah maju.
Sumber arus searah galvanik - akumulator
Sumber kimia arus listrik di mana reaksi reversibel terjadi disebut baterai isi ulang: mereka diisi ulang dan digunakan berulang kali.

Ketika baterai timbal bekerja, reaksi redoks terjadi. Timbal logam dioksidasi, melepaskan elektronnya, mereduksi timbal dioksida, yang menerima elektron. Timbal logam dalam baterai adalah anoda dan bermuatan negatif. Timbal dioksida adalah katoda dan bermuatan positif.
Saat baterai habis, zat katoda dan anoda dan elektrolitnya, asam sulfat, dikonsumsi. Untuk mengisi baterai, baterai terhubung ke sumber arus (plus ke plus, minus ke minus). Arah arus sekarang kebalikan dari saat baterai habis. Proses elektrokimia pada elektroda "terbalik". Sekarang elektroda timbal menjadi katoda, proses reduksi terjadi di atasnya, dan timbal dioksida menjadi anoda, dengan prosedur oksidasi berlangsung. Zat-zat yang diperlukan agar baterai dapat bekerja kembali dibuat di dalam baterai.
Mengapa ada kebingungan?
Masalah muncul karena tanda muatan tertentu tidak dapat melekat kuat pada anoda atau katoda. Seringkali katoda adalah elektroda bermuatan positif dan anoda adalah elektroda negatif. Sering, tapi tidak selalu.Itu semua tergantung pada proses yang terjadi di elektroda.
PERINGATAN. Bagian yang Anda masukkan ke dalam elektrolit dapat berupa anoda dan katoda. Itu semua tergantung pada tujuan proses: meletakkan lapisan logam lain di atasnya atau melepasnya.
Cara menentukan anoda dan katoda
Dalam elektrokimia, anoda adalah elektroda tempat berlangsungnya proses oksidasi, dan katoda adalah elektroda tempat terjadinya reduksi.
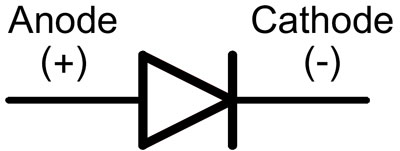
Dalam dioda, kabel disebut anoda dan katoda. Arus akan mengalir melalui dioda jika ujung "anoda" dihubungkan ke "plus" dan ujung "katoda" dihubungkan ke "minus".
Untuk LED baru dengan pin yang belum dipotong, anoda dan katoda ditentukan secara visual berdasarkan panjangnya. Katoda lebih pendek.

Jika kontak terputus, baterai yang terpasang padanya akan membantu. Cahaya akan muncul ketika polaritas cocok.
Tanda anoda dan katoda
Dalam elektrokimia, lebih tepat untuk berbicara bukan tentang tanda-tanda muatan elektroda, tetapi tentang proses yang terjadi pada mereka. Reaksi reduksi berlangsung di katoda dan reaksi oksidasi berlangsung di anoda.
Dalam teknik elektro, untuk arus mengalir, katoda dihubungkan ke kutub negatif dari sumber arus, anoda ke kutub positif.
Artikel terkait: