Azt a kérdést, hogy mi az elektrolízis, már az iskolai fizikaórák óta tárgyalják, és a legtöbb ember számára nem titok. A másik dolog a fontossága és gyakorlati alkalmazása. Ezt a folyamatot számos iparágban nagy előnnyel alkalmazzák, és az otthoni ezermesterek számára is hasznos lehet.
Tartalomjegyzék
Mi az elektrolízis?
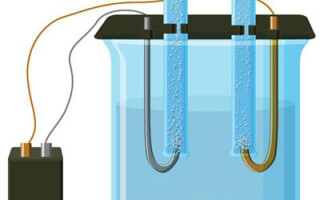
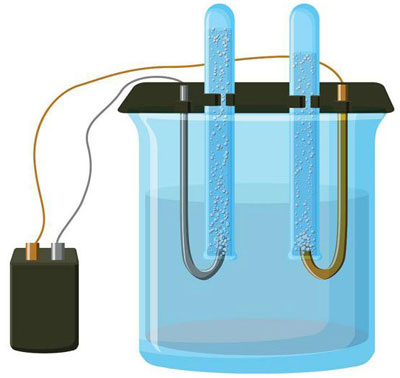
Az elektrolízis az elektród- és elektrolitrendszerben állandó elektromos áram mellett végbemenő specifikus folyamatok komplexuma. Mechanizmusa ionáram létrehozásán alapul. Az elektrolit 2-es típusú vezető (ionos vezetőképesség), amelyben elektrolitikus disszociáció történik. Ez magában foglalja a bomlást pozitív (kation) és negatív (anion) töltés.
Egy elektrolízis rendszer szükségszerűen tartalmaz egy pozitív (anód) és egy negatív (katód) elektróda. Ha egyenáramot alkalmazunk, a kationok a katód felé, az anionok pedig az anód felé mozognak. A kationok főként fémionok és hidrogén, az anionok pedig oxigén és klór. A katódon a kationok felesleges elektronokat nyernek, így lehetővé válik a redukciós reakció Men+ + ne → Me (ahol n a fém valenciája). Az anódon ezzel szemben az elektronokat az aniontól kapja vissza, és az oxidációs reakció zajlik le.
Így a redoxi folyamat biztosított a rendszerben. Fontos azonban, hogy a folyamathoz energiára van szükség. Ezt egy külső áramforrásnak kell biztosítania.
Faraday elektrolízis-törvényei
A nagy fizikus, M. Faraday nemcsak az elektrolízis természetének megértését tette lehetővé kutatásával, hanem a megvalósításához szükséges számításokat is. 1832-ben jelentek meg törvényei, amelyek összekötötték a lejátszódó folyamatok fő paramétereit.
Az első törvény
Faraday első törvénye kimondja, hogy az anódon redukált anyag tömege egyenesen arányos az elektrolitban indukált elektromos töltéssel: m = kq = k*I*t, ahol q a töltés, k az anyag együtthatója vagy elektrokémiai egyenértéke, I az elektroliton átfolyó áram és t az áram folyásának ideje.

Második törvény
Faraday második törvénye lehetővé tette a k arányossági együttható meghatározását. Ez a következőképpen hangzik: bármely anyag elektrokémiai egyenértéke egyenesen arányos a moláris tömegével és fordítottan arányos a valenciájával. A törvényt a következő formában fejezik ki:

k = 1/F*A/zahol F a Faraday-állandó, A az anyag moláris tömege, z a kémiai valencia.
Mindkét törvényt figyelembe véve levezethetjük a végső képletet az elektródon lerakódott anyag tömegének kiszámításához: m = A*I*t/(n*F)ahol n az elektrolízisben részt vevő elektronok száma. Általában n az ion töltésének felel meg. Gyakorlati szempontból fontos, hogy az anyag tömegét az alkalmazott áramhoz viszonyítsuk, ami lehetővé teszi a folyamat szabályozását az erősség változtatásával.
Olvadékok elektrolízise
Az elektrolízis egyik változata, hogy olvadékot használnak elektrolitként. Ebben az esetben csak az olvadékionok vesznek részt az elektrolitikus folyamatban. Klasszikus példa erre a NaCl sóolvadék elektrolízise (konyhasó). A negatív ionok az anód felé áramlanak, ami azt jelenti, hogy gáz szabadul fel (Cl). A katódon a fém redukciója, azaz a felesleges elektronokat vonzó pozitív ionokból képződő tiszta Na leülepedése következik be. Más fémek is előállíthatók hasonló módon (K, Ca, Li stb.) a megfelelő sók oldódásából.
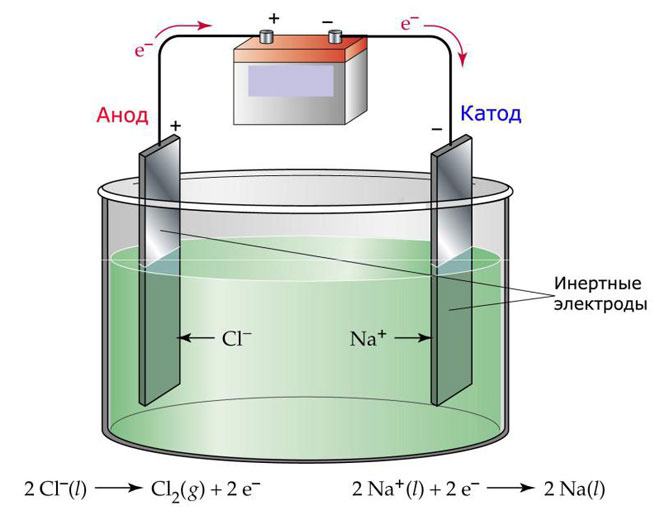
Az olvadékelektrolízisben az elektródák nem oldódnak fel, hanem csak áramforrásként vesznek részt. Előállításukhoz fém, grafit és egyes félvezetők is felhasználhatók. Fontos, hogy az anyag megfelelő vezetőképességgel rendelkezzen. Az egyik leggyakoribb anyag a réz.
Az elektrolízis jellemzői oldatokban
A vizes oldatban történő elektrolízis teljesen különbözik az olvadékelektrolízistől. Itt 3 egymással versengő folyamat játszódik le: a víz oxidációja, amely oxigént bocsát ki, az anion oxidációja és a fém anódos oldódása. A folyamatban vízionok, az elektrolit és az anód vesz részt. Ennek megfelelően a hidrogén, az elektrolit kationjai és az anódfém redukciója a katódon történhet.

Az, hogy ezek a versengő folyamatok mennyire képesek végbemenni, a rendszer elektromos potenciáljától függ. Csak az a folyamat megy végbe, amely kevesebb külső energiát igényel. Ezért a legmagasabb elektródpotenciállal rendelkező kationok a katódon redukálódnak, a legalacsonyabb potenciállal rendelkező anionok pedig az anódon oxidálódnak. A hidrogén elektródpotenciálját "0"-nak vesszük. Például káliumban ez egyenlő (-2,93 В), a nátrium (-2,71 В), ólom (-0,13 В), az ezüst esetében pedig (+0,8 В).
Elektrolízis gázokban
A gáz csak akkor tud elektrolitként működni, ha ionizátor van jelen. Ebben az esetben az ionizált közegen áram folyik keresztül, ami az elektródákon a szükséges folyamatot idézi elő. Faraday törvényei nem vonatkoznak a gázelektrolízisre. Ilyen feltételek szükségesek a megvalósulásához:
- Sem a nagyfeszültség, sem a nagy áram nem segíthet a gáz mesterséges ionizálása nélkül.
- Csak oxigénmentes gáznemű savak és bizonyos gázok alkalmasak elektrolízisre.
Fontos! A folyamat a folyékony elektrolitban történő elektrolízishez hasonlóan zajlik, ha a szükséges feltételek teljesülnek.
A katódon és az anódon lejátszódó folyamatok jellemzői
Az elektrolízis gyakorlati alkalmazásához fontos megérteni, hogy mi történik a két elektródánál, amikor elektromos áramot kapcsolunk rá. A következő folyamatok jellemzőek:
- Katód. A pozitív töltésű ionok feléje rohannak. Itt történik a fémek redukciója vagy a hidrogén felszabadulása. A fémek több kategóriája különböztethető meg kationos aktivitásuk szerint. Az olyan fémek, mint a Li, K, Ba, St, Ca, Na, Mg, Be, Al csak olvadt sókból redukálódnak jól. Ha oldatot használunk, a víz elektrolízise révén hidrogén szabadul fel. A következő fémek nyerhetők vissza oldatban, de megfelelő kationkoncentráció mellett: Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. A folyamat a legegyszerűbb az Ag, Cu, Bi, Pt, Au, Hg esetében.
- Anód. A negatív töltésű ionokat erre az elektródra vezetik. Oxidációjuk során elektronokat vonnak el a fémtől, ami anódos oldódáshoz vezet, azaz. Az anionok pozitív töltésű ionokká alakulnak, amelyek a katód felé irányulnak. Az anionokat aktivitásuk szerint is felosztják. Az olvadékból csak a PO4, CO3, SO4, NO3, NO2, ClO4, F anionok üríthetők ki. Vizes oldatokban nem elektrolízisnek, hanem víznek vannak kitéve oxigén felszabadulásával. A legkönnyebben reagáló anionok az OH, Cl, I, S és Br.

Az elektrolízis biztosítása során fontos figyelembe venni az elektróda anyagának oxidációs hajlamát. Megkülönböztetünk inert és aktív anódokat. Az inert elektródák grafitból, szénből vagy platinából készülnek, és nem vesznek részt az ionellátásban.
Az elektrolízis folyamatát befolyásoló tényezők
Az elektrolízis folyamata a következő tényezőktől függ
- Az elektrolit összetétele. Jelentős hatást gyakorolnak a különböző szennyeződések. Ezeket 3 típusba soroljuk - kationok, anionok és szerves anyagok. Az anyagok több vagy kevesebb negatívummal rendelkezhetnek, mint az alapfém, és ez zavarja a folyamatot. A szerves szennyeződések között vannak szennyező anyagok (pl. olajok) és felületaktív anyagok. Koncentrációjuk a megengedett maximális értékeket éri el.
- Áramsűrűség. Faraday törvénye szerint a lerakódott anyag tömege az áram erősségével együtt nő. Előfordulnak azonban kedvezőtlen körülmények - koncentrált polarizáció, megnövekedett feszültség, az elektrolit intenzív felmelegedése. Ezt szem előtt tartva minden esetben vannak optimális értékek az áramsűrűségre.
- elektrolit pH. A közeg savasságát is a fémek figyelembevételével választják ki. Például a cink optimális pH-értéke 140 g/cc.
- Elektrolyt hőmérséklet. Ennek kétértelmű hatása van. A hőmérséklet növekedésével az elektrolízis sebessége nő, de a szennyeződések aktivitása is. Minden folyamathoz létezik egy optimális hőmérséklet. Általában 38 és 45 fok között van.
Fontos! Az elektrolízist különböző hatások és az elektrolit összetételének megválasztása gyorsíthatja vagy lassíthatja. Minden egyes alkalmazáshoz más-más rendszer tartozik, amelyet szigorúan be kell tartani.
Hol használják az elektrolízist?
Az elektrolízist számos alkalmazásban használják. A gyakorlati eredmények szempontjából több fő felhasználási módot különböztethetünk meg.
Galvanizálás
Vékony, szívós galvanizált fémbevonatokat lehet alkalmazni elektrolízissel. A bevont tárgyat katódként egy fürdőbe helyezik, az elektrolit pedig a kívánt fém sóját tartalmazza. Így lehet az acélt cinkkel, krómmal vagy ónnal bevonni.

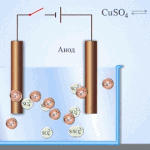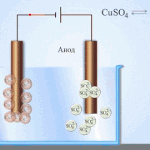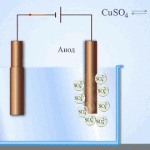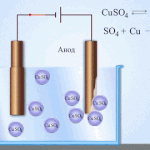
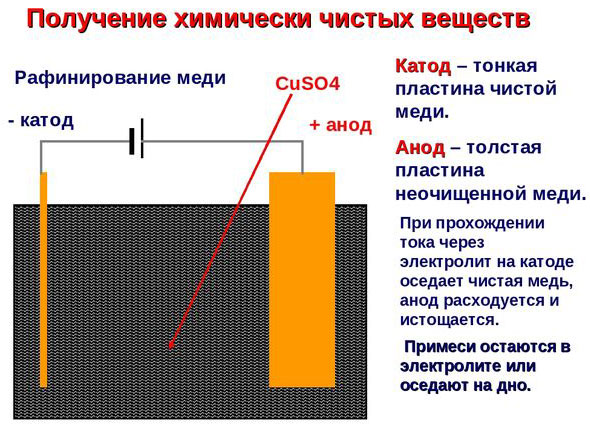
Elektrofinomítás - rézfinomítás
Egy példa az elektrokezelésre a következő lenne katód - tiszta réz anód - réz szennyeződésekkel, elektrolit - vizes réz-szulfátoldat. Az anódból származó réz ionokká alakul át, és szennyeződések nélkül a katódban rakódik le.
Fémkivonás
A fémek sókból történő kivonásához a fémeket megolvasztják, majd az olvadékban elektrolízissel oldják ki. Ez az eljárás igen hatékony az alumínium bauxitból, nátriumból és káliumból történő kinyerésében.

Eloxálás
Ebben az eljárásban a bevonat nem fémes vegyületekből készül. A klasszikus példa az alumínium eloxálása. Az alumínium rész anódként van felszerelve. Az elektrolit kénsavoldat. Az elektrolízis eredményeként az anódon egy alumínium-oxid réteg rakódik le, amely védő és dekoratív tulajdonságokkal rendelkezik. A fenti technológiákat széles körben használják a különböző iparágakban. A folyamatokat saját kezűleg és biztonságosan is el lehet végezni.
Energiaköltségek
Az elektrolízis nagy mennyiségű energiát igényel. Az eljárás akkor lesz gyakorlati értékű, ha az anódáram elegendő, amihez jelentős egyenáramot kell alkalmazni az áramforrásból. Ezen túlmenően oldalsó feszültségveszteségeket - anódos és katódos túlfeszültségeket, valamint az elektrolit ellenállása miatt veszteségeket okoz. Az üzem hatásfokát úgy határozzuk meg, hogy a bevitt energia teljesítményét a kinyert anyag hasznos tömegének egységére vonatkoztatjuk.
Az elektrolízist már régóta nagy hatékonysággal alkalmazzák az iparban. Az eloxálás és a galvanizálás a mindennapi életben mindennapossá vált, az anyagnyerés és -feldolgozás pedig számos fém ércből való kinyerését segíti elő. A folyamat tervezhető és kiszámítható az alapminták ismeretében.
Kapcsolódó cikkek: