Gyakran problémát jelent annak eldöntése, hogy melyik elektróda a katód és melyik az anód. Jó kezdet a fogalmak meghatározása.
Tartalom
A katód és az anód fogalma - egyszerű magyarázat
Az összetett anyagokban az elektronok a vegyületek atomjai között nem egyenletesen oszlanak el. A kölcsönhatás hatására a részecskék az egyik anyag atomjából egy másik anyag atomjába kerülnek. A reakciót oxidációs-redukciós reakciónak nevezzük. Az elektronvesztést oxidációnak nevezzük, az elektront leadó elemet redukáló anyagnak.
Az elektronok hozzáadását nevezzük redukciónak, az elektronokat átvevő elemet pedig oxidálónak. Az elektronok átadása a redukálószerről az oxidálószerre egy külső áramkörön keresztül történhet, és ezután elektromos energiaforrásként használható. Azokat az eszközöket, amelyek a kémiai reakció energiáját elektromos energiává alakítják, galvánelemeknek nevezik.
A galvánelem legegyszerűbb klasszikus példája két különböző fémből készült, elektrolitoldatba merített lemez. Ebben a rendszerben az egyik fémen oxidáció, a másikon pedig redukció megy végbe.
FONTOS! Az elektródot, ahol az oxidáció végbemegy, anódnak nevezzük. Az elektródot, ahol a redukció végbemegy, katódnak nevezzük.
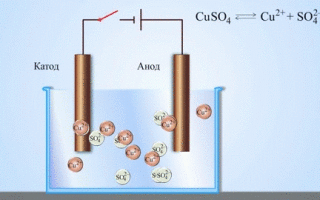
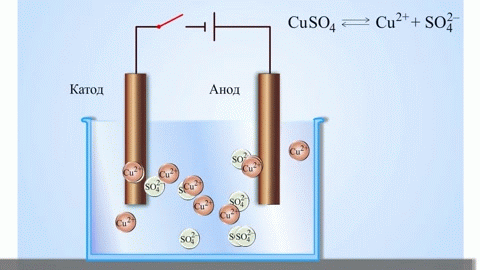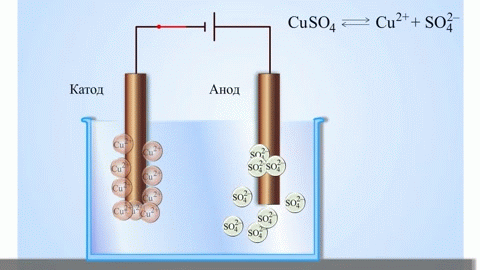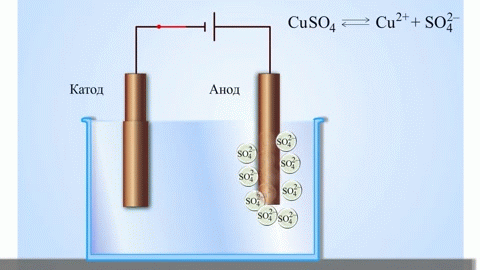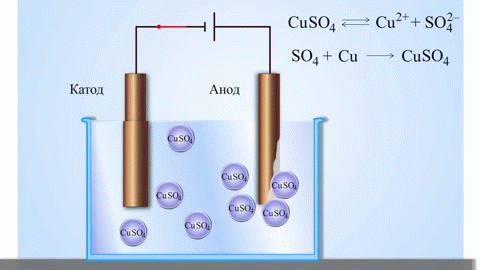
A réz-cink galvánelem, amely a cink és a réz-szulfát közötti reakció energiájának elnyelésével működik, az iskolai kémia tankönyvekből jól ismert példa. A Jacoby-Daniel készülékben egy rézlemezt rézszulfátoldatba helyeznek (rézelektród), és egy cinklemezt cinkszulfátoldatba merítenek (cinkelektród). A cinkelektród kationokat ad le az oldatba, ami pozitív töltést eredményez benne, míg a rézelektródnál az oldat kationokban szegényedik, itt az oldat negatív töltésű.
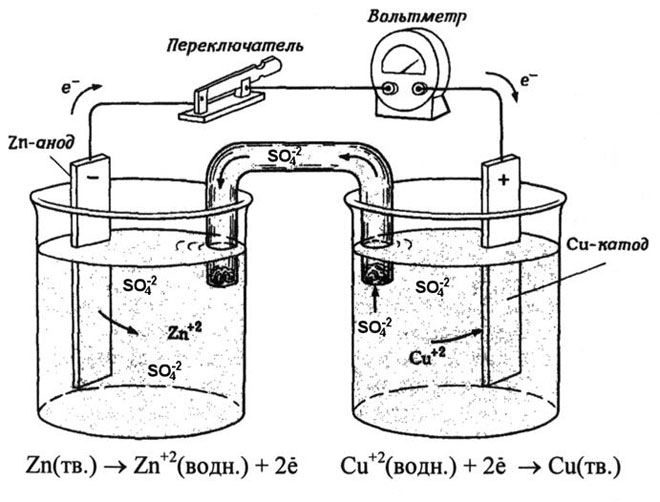
A külső áramkör bezárásával elektronok áramlanak a cinkelektródáról a rézelektródára. Az egyensúlyi viszonyok a fázishatárokon megszakadnak. Redox-reakció megy végbe.
A spontán kémiai reakció energiája elektromos energiává alakul.
Ha a kémiai reakciót külső elektromos energia váltja ki, akkor elektrolízisnek nevezett folyamatról van szó. Az elektrolízis során lejátszódó folyamatok a galvánelem működése során lejátszódó folyamatok fordítottjai.
FIGYELEM! Az elektródot, amelyen a redukció végbemegy, katódnak is nevezik, de az elektrolízis során negatívan töltött, az anód pedig pozitívan töltött.
Elektrokémiai alkalmazások
Az anódok és katódok számos kémiai reakcióban vesznek részt:
- Elektrolízis;
- Elektroextrakció;
- Galvanizálás;
- Galvanizálás.
Az olvadt vegyületek és vizes oldatok elektrolízise során fémeket állítanak elő, tisztítják a fémeket a szennyeződésektől és kivonják az értékes összetevőket (elektrolitikus finomítás). A lemezeket a finomítandó fémből öntik. A lemezek anódként kerülnek az elektrolízisbe. A fémet elektromos árammal oldják fel. Kationjai az oldatba kerülnek, és a katódon kiürülnek, tiszta fém csapadékát képezve. Az eredeti nyers fémlemezben lévő szennyeződések vagy anódiszapként oldhatatlanok maradnak, vagy az elektrolitba kerülnek, ahol eltávolítják őket. A réz, nikkel, ólom, arany, ezüst és ón elektrolitikus finomításon esik át.
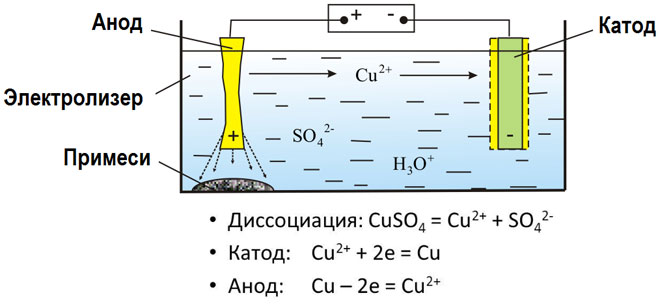
Az elektroextrakció a fémek oldatból történő kivonásának folyamata elektrolízis során. A fém oldatba való átviteléhez speciális reagensekkel kezelik. Az eljárás során a katódon nagy tisztaságú fém válik le. Így állítják elő a cinket, a rezet és a kadmiumot.
A korrózió elkerülése, a termék erősebbé és dekoratívabbá tétele érdekében az egyik fém felületét egy másik fémmel bevonják. Ezt az eljárást galvanizálásnak nevezik.

Az elektroformázás a háromdimenziós tárgyak fémmásolatainak elektroleválasztással történő előállítása.

Vákuumelektronikai alkalmazások
A katód és az anód elvét egy vákuumkészülékben egy elektroncső segítségével lehet bemutatni. Úgy néz ki, mint egy hermetikusan lezárt edény fém alkatrészekkel a belsejében. A készüléket elektromos jelek egyenirányítására, előállítására és átalakítására használják. Az elektródák száma szerint megkülönböztetünk:
- diódák;
- triódák;
- tetródák;
- pentódák stb.
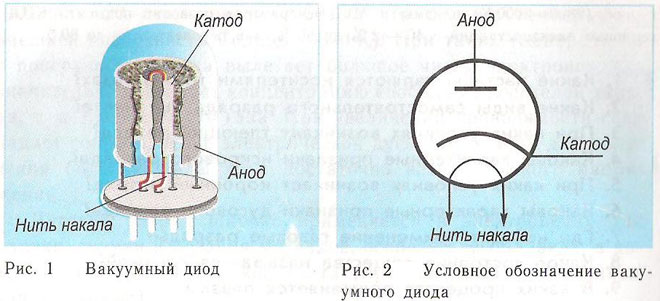
A dióda két elektródával, egy katóddal és egy anóddal rendelkező vákuumos eszköz. A katód a tápegység negatív pólusához, az anód pedig a pozitív pólushoz csatlakozik. A katód célja, hogy elektronokat bocsásson ki, amikor elektromos árammal bizonyos hőmérsékletre melegítik. Az elektronokat arra használják, hogy a katód és az anód között térbeli töltést hozzanak létre. A leggyorsabb elektronok az anód felé rohannak, áthaladva a negatív potenciálgáton, a tér töltésén. Az anód fogadja a részecskéket. A külső áramkörben anódos áram keletkezik. Az elektronáramlást további elektródák segítségével szabályozzák, amelyeket elektromos potenciállal látnak el. A diódák a váltakozó áramot egyenárammá alakítják.
Elektronikai alkalmazások
Manapság félvezető típusú diódákat használnak.
Az elektronikában széles körben használják a diódák azon tulajdonságát, hogy az áramot az előremenő irányban átengedik, a hátramenő irányban pedig nem.
A LED működése a félvezető kristályok azon tulajdonságán alapul, hogy izzanak, amikor a p-n átmenetben áram folyik át előrefelé.
Galvanikus egyenáramforrások - akkumulátorok
Az olyan kémiai elektromos áramforrásokat, amelyekben reverzibilis reakciók játszódnak le, újratölthető akkumulátoroknak nevezzük: ezek újratölthetők és ismételten használhatók.

Amikor egy ólom-sav akkumulátor működik, redoxireakció megy végbe. A fémes ólom oxidálódik és leadja elektronjait, csökkentve az ólom-dioxidot, amely felveszi az elektronokat. Az akkumulátorban lévő fémes ólom az anód, amely negatív töltésű. Az ólom-dioxid a katód, és pozitív töltésű.
Az akkumulátor kisülése során a katód és az anód anyagai és elektrolitjuk, a kénsav, elhasználódnak. Az akkumulátor töltéséhez egy áramforráshoz kell csatlakoztatni (plusz a pluszhoz, mínusz a mínuszhoz). Az áram iránya most ellentétes az akkumulátor lemerülésekor mért irányhoz képest. Az elektrokémiai folyamatok az elektródákon "megfordulnak". Az ólomelektród most katóddá válik, és a redukciós folyamat ott zajlik, az ólom-dioxid pedig anóddá válik, és ott zajlik az oxidációs folyamat. Az akkumulátorhoz szükséges anyagok ismét az akkumulátorban keletkeznek.
Miért van ez a zűrzavar?
A probléma azért merül fel, mert egy adott töltésjelet nem lehet szilárdan sem az anódhoz, sem a katódhoz kötni. Gyakran a katód a pozitív töltésű elektród, az anód pedig a negatív elektród. Gyakran, de nem mindig. Minden az elektródon zajló folyamattól függ.
FIGYELEM! Az elektrolitba helyezett alkatrész egyszerre lehet anód és katód. Ez a folyamat céljától függ: egy újabb fémréteg felhordása vagy egy fémréteg eltávolítása.
Az anód és a katód azonosítása
Az elektrokémiában az anód az az elektród, ahol oxidációs folyamatok zajlanak, a katód pedig az az elektród, ahol redukció történik.
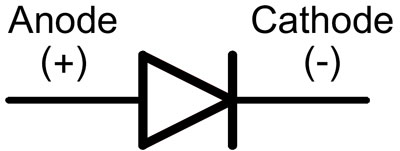
A diódában a vezetékeket anódnak és katódnak nevezik. Az áram akkor folyik át a diódán, ha az anódot a "plusz", a katódot pedig a "mínusz" vezetékhez csatlakoztatjuk.
Egy új, vágatlan csapokkal rendelkező LED esetében az anód és a katód vizuálisan, a hossz alapján határozható meg. A katód rövidebb.

Ha az érintkezők elvágódtak, egy hozzájuk csatlakoztatott akkumulátor segít. A fény akkor jelenik meg, ha a polaritások megegyeznek.
Az anód és a katód előjele
Az elektrokémiában helyesebb az elektródokon lejátszódó folyamatokról beszélni, mint az elektródok jeleiről. A redukciós reakció a katódon, az oxidációs reakció pedig az anódon megy végbe.
Az elektrotechnikában a katódot az áramforrás negatív pólusához, az anódot pedig a pozitív pólushoz csatlakoztatják.
Kapcsolódó cikkek: