अक्सर यह निर्धारित करने में समस्या होती है कि कौन सा इलेक्ट्रोड कैथोड है और कौन सा एनोड है। आरंभ करने के लिए, हमें शर्तों को समझने की आवश्यकता है।
अंतर्वस्तु
कैथोड और एनोड की अवधारणा - एक सरल व्याख्या
जटिल पदार्थों में, यौगिकों में परमाणुओं के बीच इलेक्ट्रॉनों को समान रूप से वितरित नहीं किया जाता है। परस्पर क्रिया के परिणामस्वरूप कण एक पदार्थ के परमाणु से दूसरे पदार्थ के परमाणु में चले जाते हैं। प्रतिक्रिया को रेडॉक्स प्रतिक्रिया कहा जाता है। इलेक्ट्रॉनों के नुकसान को ऑक्सीकरण कहा जाता है, जो तत्व इलेक्ट्रॉनों को छोड़ देता है उसे कम करने वाला एजेंट कहा जाता है।
इलेक्ट्रॉनों के जोड़ को कमी कहा जाता है; इस प्रक्रिया में इलेक्ट्रॉनों को ग्रहण करने वाला तत्व आक्सीकारक है। कम करने वाले एजेंट से ऑक्सीकरण एजेंट में इलेक्ट्रॉनों का स्थानांतरण बाहरी सर्किट के माध्यम से प्रवाहित हो सकता है, और फिर इसे विद्युत ऊर्जा के स्रोत के रूप में उपयोग किया जा सकता है। वे उपकरण जिनमें रासायनिक अभिक्रिया की ऊर्जा को विद्युत ऊर्जा में परिवर्तित किया जाता है, गैल्वेनिक सेल कहलाते हैं।
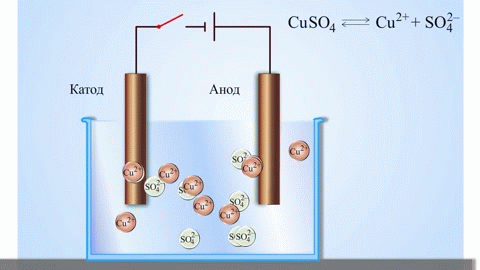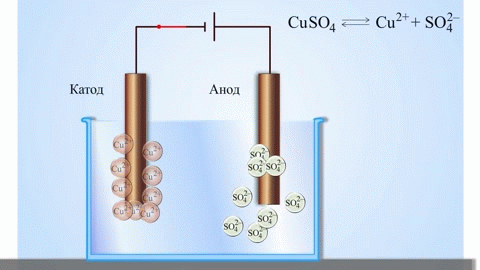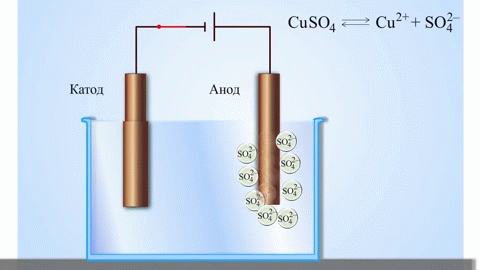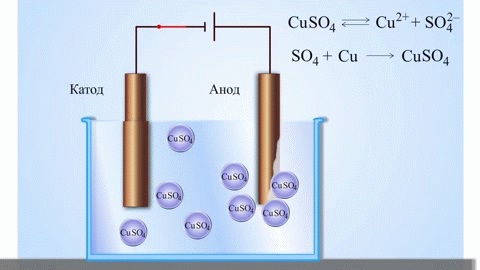
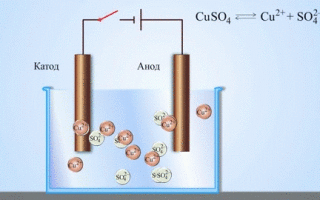
गैल्वेनिक सेल का सबसे सरल क्लासिक उदाहरण विभिन्न धातुओं से बनी दो प्लेटें हैं और इलेक्ट्रोलाइट समाधान में डूबी हुई हैं।ऐसी प्रणाली में, एक धातु पर ऑक्सीकरण होता है और दूसरी पर कमी होती है।
महत्वपूर्ण! जिस इलेक्ट्रोड में ऑक्सीकरण होता है उसे एनोड कहा जाता है। जिस इलेक्ट्रोड में अपचयन होता है उसे कैथोड कहते हैं।
स्कूल की रसायन शास्त्र की पाठ्यपुस्तकों से हम कॉपर-जिंक गैल्वेनिक सेल का एक उदाहरण जानते हैं, जो जिंक और कॉपर सल्फेट के बीच प्रतिक्रिया की ऊर्जा के कारण काम करता है। जैकोबी-डैनियल के उपकरण में, कॉपर सल्फेट (कॉपर इलेक्ट्रोड) के घोल में एक कॉपर प्लेट रखी जाती है, और जिंक प्लेट को जिंक सल्फेट (जिंक इलेक्ट्रोड) के घोल में डुबोया जाता है। जिंक इलेक्ट्रोड विलयन में धनायन देता है, जिससे उसमें एक अतिरिक्त धनात्मक आवेश उत्पन्न होता है, जबकि कॉपर इलेक्ट्रोड पर विलयन में धनायन समाप्त हो जाते हैं, यहाँ विलयन ऋणात्मक रूप से आवेशित हो जाता है।
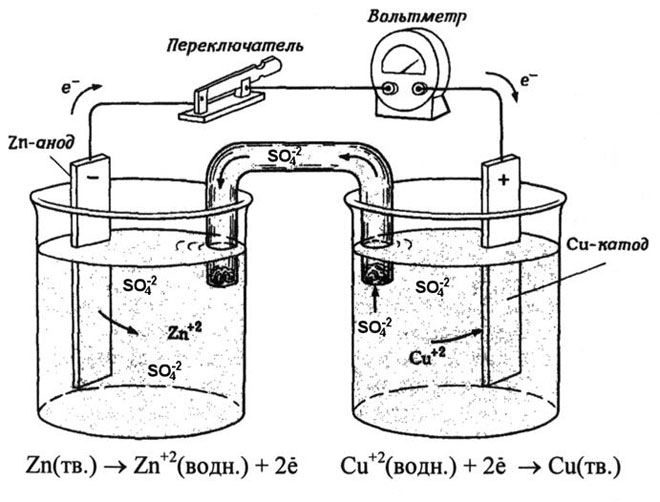
बाहरी सर्किट के बंद होने से जिंक इलेक्ट्रोड से कॉपर इलेक्ट्रोड में इलेक्ट्रॉनों का प्रवाह होता है। चरण सीमाओं पर संतुलन संबंध बाधित होते हैं। रेडॉक्स अभिक्रिया होती है।
सहज रासायनिक प्रतिक्रिया की ऊर्जा विद्युत ऊर्जा में बदल जाती है।
यदि रासायनिक प्रतिक्रिया विद्युत प्रवाह की बाहरी ऊर्जा से उत्तेजित होती है, तो इलेक्ट्रोलिसिस नामक एक प्रक्रिया होती है। इलेक्ट्रोलिसिस में शामिल प्रक्रियाएं गैल्वेनिक सेल के संचालन में शामिल प्रक्रियाओं के विपरीत होती हैं।
चेतावनी। जिस इलेक्ट्रोड में कमी होती है उसे कैथोड भी कहा जाता है, लेकिन इलेक्ट्रोलिसिस में यह ऋणात्मक रूप से आवेशित होता है और एनोड धनात्मक रूप से आवेशित होता है।
विद्युत रासायनिक अनुप्रयोग
एनोड और कैथोड कई रासायनिक प्रतिक्रियाओं में भाग लेते हैं:
- इलेक्ट्रोलिसिस;
- इलेक्ट्रो-निष्कर्षण;
- विद्युत चढ़ाना;
- इलेक्ट्रोप्लेटिंग।
पिघले हुए यौगिकों और जलीय घोलों का इलेक्ट्रोलिसिस धातुओं का उत्पादन करता है, धातुओं को अशुद्धियों से शुद्ध करता है और मूल्यवान घटकों (इलेक्ट्रोलाइटिक रिफाइनिंग) को निकालता है। परिष्कृत करने के लिए प्लेटों को धातु से ढाला जाता है। प्लेटों को इलेक्ट्रोलाइजर में एनोड के रूप में रखा जाता है। धातु एक विद्युत प्रवाह द्वारा भंग कर दी जाती है।इसके धनायन विलयन में चले जाते हैं और कैथोड पर निर्मुक्त हो जाते हैं, जिससे शुद्ध धातु का अवक्षेप बनता है। मूल कच्चे धातु की प्लेट में निहित अशुद्धियाँ या तो एनोडिक कीचड़ के रूप में अघुलनशील रहती हैं या इलेक्ट्रोलाइट में चली जाती हैं, जिससे उन्हें हटा दिया जाता है। तांबा, निकल, सीसा, सोना, चांदी और टिन इलेक्ट्रोलाइटिक शोधन के अधीन हैं।
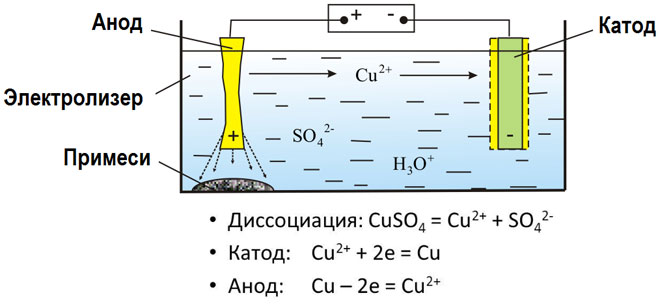
इलेक्ट्रोएक्स्ट्रक्शन इलेक्ट्रोलिसिस के दौरान समाधान से धातु निकालने की प्रक्रिया है। धातु को विशेष अभिकर्मकों के साथ इलाज किया जाता है ताकि इसे समाधान में पारित किया जा सके। प्रक्रिया के दौरान कैथोड पर उच्च शुद्धता की विशेषता वाली एक धातु छोड़ी जाती है। इस प्रकार जस्ता, तांबा और कैडमियम का उत्पादन होता है।
जंग से बचने, ताकत देने और उत्पाद को सजाने के लिए, एक धातु की सतह को दूसरे की परत से ढक दिया जाता है। इस प्रक्रिया को इलेक्ट्रोप्लेटिंग कहा जाता है।

इलेक्ट्रोप्लेटिंग धातु के इलेक्ट्रो-डिपोजिशन द्वारा त्रि-आयामी वस्तुओं की धातु की प्रतियां बनाने की एक प्रक्रिया है।

वैक्यूम इलेक्ट्रॉनिक उपकरणों में उपयोग करें
एक निर्वात उपकरण में कैथोड और एनोड के सिद्धांत को एक इलेक्ट्रॉन ट्यूब द्वारा प्रदर्शित किया जा सकता है। यह अंदर धातु भागों के साथ एक भली भांति बंद करके सील किए गए बर्तन जैसा दिखता है। डिवाइस का उपयोग विद्युत संकेतों को सुधारने, उत्पन्न करने और परिवर्तित करने के लिए किया जाता है। इलेक्ट्रोड की संख्या के अनुसार प्रतिष्ठित हैं:
- डायोड;
- ट्रायोड;
- टेट्रोड;
- पेंटोड्स, आदि
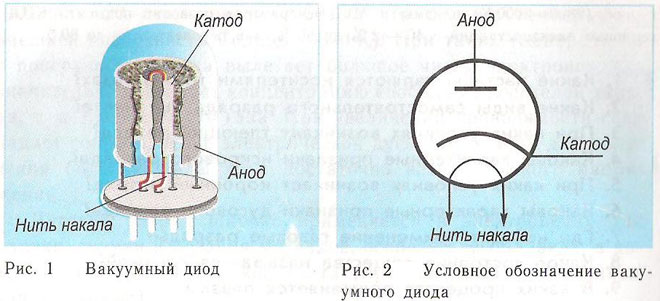
डायोड एक वैक्यूम डिवाइस है जिसमें दो इलेक्ट्रोड, एक कैथोड और एक एनोड होता है। कैथोड बिजली की आपूर्ति के नकारात्मक ध्रुव, सकारात्मक ध्रुव के एनोड से जुड़ा है। कैथोड का उद्देश्य एक निश्चित तापमान पर विद्युत प्रवाह के ताप के प्रभाव में इलेक्ट्रॉनों का उत्सर्जन करना है। उत्सर्जित इलेक्ट्रॉनों के माध्यम से, कैथोड और एनोड के बीच एक स्थानिक आवेश उत्पन्न होता है। अंतरिक्ष आवेश के नकारात्मक संभावित अवरोध को पार करते हुए, सबसे तेज़ इलेक्ट्रॉन एनोड की ओर भागते हैं। एनोड इन कणों को प्राप्त करता है। बाहरी सर्किट में एनोडिक करंट बनता है।इलेक्ट्रॉन प्रवाह को अतिरिक्त इलेक्ट्रोड के माध्यम से विद्युत क्षमता को लागू करके नियंत्रित किया जाता है। डायोड का उपयोग प्रत्यावर्ती धारा को दिष्ट धारा में बदलने के लिए किया जाता है।
इलेक्ट्रॉनिक्स अनुप्रयोग
आज, अर्धचालक प्रकार के डायोड का उपयोग किया जाता है।
डायोड की संपत्ति को आगे की दिशा में करंट पास करने और रिवर्स दिशा में करंट पास न करने का गुण इलेक्ट्रॉनिक्स में व्यापक रूप से उपयोग किया जाता है।
एलईडी ऑपरेशन अर्धचालक क्रिस्टल के चमकने के गुण पर आधारित होता है जब करंट पी-एन जंक्शन से आगे की दिशा में गुजरता है।
प्रत्यक्ष धारा के गैल्वेनिक स्रोत - संचायक
विद्युत प्रवाह के रासायनिक स्रोत जिनमें प्रतिवर्ती प्रतिक्रियाएं होती हैं, उन्हें रिचार्जेबल बैटरी कहा जाता है: उन्हें रिचार्ज किया जाता है और बार-बार उपयोग किया जाता है।

जब एक लेड बैटरी काम करती है, तो एक रेडॉक्स प्रतिक्रिया होती है। धातु का लेड ऑक्सीकरण होता है, अपने इलेक्ट्रॉनों को छोड़ देता है, लेड डाइऑक्साइड को कम करता है, जो इलेक्ट्रॉनों को प्राप्त करता है। बैटरी में धात्विक लेड एनोड है और ऋणात्मक रूप से चार्ज होता है। लेड डाइऑक्साइड कैथोड है और धनावेशित है।
जैसे ही बैटरी डिस्चार्ज होती है, कैथोड और एनोड के पदार्थ और उनके इलेक्ट्रोलाइट, सल्फ्यूरिक एसिड का सेवन किया जाता है। बैटरी को चार्ज करने के लिए, यह एक वर्तमान स्रोत (प्लस से प्लस, माइनस से माइनस) से जुड़ा है। करंट की दिशा अब बैटरी के डिस्चार्ज होने के समय के विपरीत है। इलेक्ट्रोड पर विद्युत रासायनिक प्रक्रियाएं "उलट" होती हैं। अब लेड इलेक्ट्रोड कैथोड बन जाता है, उस पर रिडक्शन प्रोसेस होता है और लेड डाइऑक्साइड एनोड बन जाता है, जिसमें ऑक्सीकरण प्रक्रिया हो रही है। बैटरी के काम करने के लिए आवश्यक पदार्थ फिर से बैटरी में बनते हैं।
भ्रम क्यों है?
समस्या इसलिए उत्पन्न होती है क्योंकि चार्ज का एक विशेष चिन्ह एनोड या कैथोड से मजबूती से जुड़ा नहीं हो सकता है। अक्सर कैथोड धनात्मक रूप से आवेशित इलेक्ट्रोड होता है और एनोड ऋणात्मक इलेक्ट्रोड होता है। अक्सर, लेकिन हमेशा नहीं।यह सब इलेक्ट्रोड पर होने वाली प्रक्रिया पर निर्भर करता है।
चेतावनी। इलेक्ट्रोलाइट में आप जो हिस्सा डालते हैं वह एनोड और कैथोड दोनों हो सकता है। यह सब प्रक्रिया के उद्देश्य पर निर्भर करता है: उस पर धातु की एक और परत लगाना या उसे उतारना।
एनोड और कैथोड का निर्धारण कैसे करें
इलेक्ट्रोकैमिस्ट्री में, एनोड इलेक्ट्रोड होता है जहां ऑक्सीकरण प्रक्रियाएं होती हैं, और कैथोड इलेक्ट्रोड होता है जहां कमी होती है।
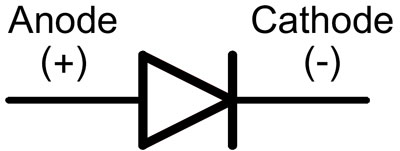
डायोड में, लीड को एनोड और कैथोड कहा जाता है। डायोड के माध्यम से करंट प्रवाहित होगा यदि "एनोड" लीड "प्लस" से जुड़ा है और "कैथोड" लीड "माइनस" से जुड़ा है।
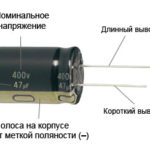
बिना काटे पिन वाली एक नई एलईडी के लिए, एनोड और कैथोड को लंबाई से नेत्रहीन निर्धारित किया जाता है। कैथोड छोटा होता है।

यदि संपर्क कट जाते हैं, तो उनसे जुड़ी एक बैटरी मदद करेगी। प्रकाश तब दिखाई देगा जब ध्रुवों का मिलान होगा।
एनोड और कैथोड का चिन्ह
इलेक्ट्रोकैमिस्ट्री में, इलेक्ट्रोड के आवेशों के संकेतों के बारे में नहीं, बल्कि उन पर चल रही प्रक्रियाओं के बारे में बात करना अधिक सही है। अपचयन अभिक्रिया कैथोड पर तथा ऑक्सीकरण अभिक्रिया एनोड पर होती है।
इलेक्ट्रिकल इंजीनियरिंग में, करंट के प्रवाह के लिए, कैथोड को करंट सोर्स के नेगेटिव पोल, एनोड से पॉजिटिव पोल से जोड़ा जाता है।
संबंधित आलेख: