La cuestión de qué es la electrólisis se discute desde el curso de física del colegio y no es un secreto para la mayoría de la gente. Otra cosa es su importancia y aplicación práctica. Este proceso se utiliza con gran ventaja en diversas industrias y puede resultar útil para el manitas de casa.
Contenido
- 1 ¿Qué es la electrólisis?
- 2 Las leyes de Faraday sobre la electrólisis
- 3 Electrólisis de fundidos
- 4 Características de la electrólisis en soluciones
- 5 Electrólisis en gases
- 6 Características de los procesos que ocurren en el cátodo y el ánodo
- 7 Factores que afectan al proceso de electrólisis
- 8 ¿Dónde se aplica la electrólisis?
- 9 Costes energéticos
¿Qué es la electrólisis?
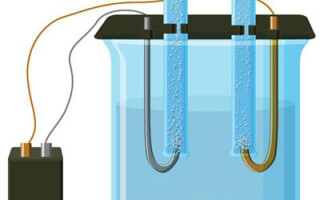
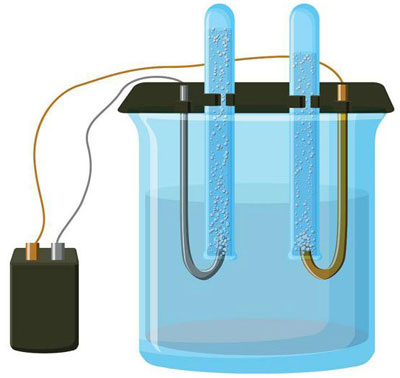
La electrólisis es un complejo de procesos específicos en un sistema de electrodos y electrolitos con una corriente eléctrica constante. Su mecanismo se basa en la generación de una corriente iónica. El electrolito es un conductor de tipo 2 (conductividad iónica) en el que se produce la disociación electrolítica. Se trata de la descomposición en iones con signo positivo (cación) y negativo (anión).
Un sistema de electrólisis contiene necesariamente un positivo (ánodo) y un negativo (cátodo). Cuando se aplica una corriente eléctrica continua, los cationes se desplazan hacia el cátodo y los aniones hacia el ánodo. Los cationes son principalmente iones metálicos e hidrógeno, y los aniones son oxígeno y cloro. En el cátodo, los cationes ganan un exceso de electrones, lo que permite la reacción de reducción Men+ + ne → Me (donde n es la valencia del metal). En el ánodo, por el contrario, se devuelven los electrones del anión, produciéndose la reacción de oxidación.
Así, el proceso redox está asegurado en el sistema. Sin embargo, lo importante es que el proceso requiere energía. Esta debe ser proporcionada por una fuente de corriente externa.
Las leyes de Faraday sobre la electrólisis
El gran físico M. Faraday no sólo hizo posible con sus investigaciones la comprensión de la naturaleza de la electrólisis, sino también los cálculos necesarios para su realización. En 1832 aparecieron sus leyes, que relacionan los principales parámetros de los procesos que se producen.
La primera ley
La primera ley de Faraday establece que la masa de una sustancia reducida en el ánodo es directamente proporcional a la carga eléctrica inducida en el electrolito: m = kq = k*I*t, donde q es la carga, k es el coeficiente o equivalente electroquímico de la sustancia, I es la corriente que circula por el electrolito y t es el tiempo de circulación de la corriente.

Segunda ley
La segunda ley de Faraday permitió determinar el coeficiente de proporcionalidad k. Dice así: el equivalente electroquímico de cualquier sustancia es directamente proporcional a su masa molar e inversamente proporcional a su valencia. La ley se expresa en la forma:

k = 1/F*A/zdonde F es la constante de Faraday, A es la masa molar de la sustancia, z es su valencia química.
Teniendo en cuenta ambas leyes, se puede derivar la fórmula final para calcular la masa de la sustancia depositada en el electrodo: m = A*I*t/(n*F)donde n es el número de electrones que intervienen en la electrólisis. Normalmente n corresponde a la carga del ion. Desde un punto de vista práctico, es importante relacionar la masa de la sustancia con la corriente aplicada, lo que permite controlar el proceso variando su fuerza.
Electrólisis de fundidos
Una de las variantes de la electrólisis consiste en utilizar una masa fundida como electrolito. En este caso, sólo los iones fundidos participan en el proceso electrolítico. Un ejemplo clásico es la electrólisis de la sal fundida NaCl (sal de mesa). Los iones negativos se dirigen al ánodo, lo que significa que se libera gas (Cl). En el cátodo se producirá una reducción del metal, es decir, la sedimentación de Na puro, formado a partir de los iones positivos, que han atraído el exceso de electrones. Otros metales pueden producirse de forma similar (K, Ca, Li, etc.) de la disolución de las respectivas sales.
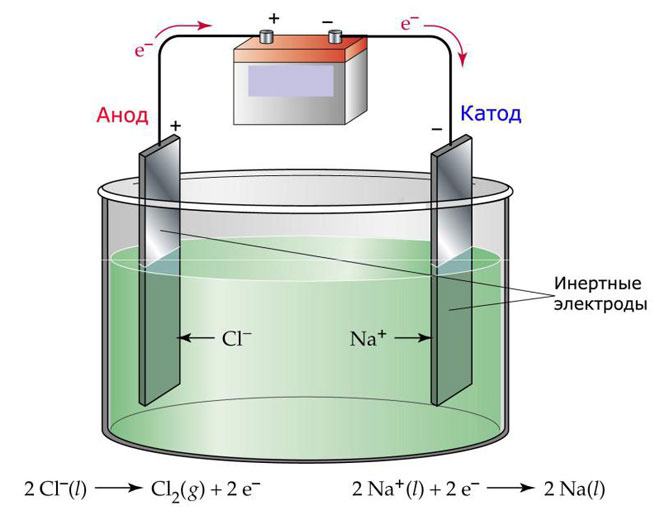
En la electrólisis fundida, los electrodos no sufren disolución, sino que sólo participan como fuente de corriente. En su fabricación pueden utilizarse metales, grafito y algunos semiconductores. Es importante que el material tenga suficiente conductividad. Uno de los materiales más comunes es el cobre.
Características de la electrólisis en soluciones
La electrólisis en una solución acuosa es muy diferente de la electrólisis en fusión. Aquí hay 3 procesos que compiten entre sí: la oxidación del agua que desprende oxígeno, la oxidación del anión y la disolución anódica del metal. En el proceso intervienen los iones de agua, el electrolito y el ánodo. Por consiguiente, la reducción del hidrógeno, los cationes del electrolito y el metal del ánodo puede tener lugar en el cátodo.

La capacidad de estos procesos en competencia depende del potencial eléctrico del sistema. Sólo tendrá lugar el proceso que requiera menos energía externa. Por lo tanto, los cationes con el mayor potencial del electrodo se reducirán en el cátodo, y los aniones con el menor potencial se oxidarán en el ánodo. El potencial de electrodo del hidrógeno se toma como "0". Por ejemplo, en el potasio es igual a (-2,93 В), el sodio es (-2,71 В), el plomo (-0,13 В), y para la plata es (+0,8 В).
Electrólisis en gases
El gas sólo puede actuar como electrolito si hay un ionizador. En este caso, la corriente fluye a través del medio ionizado, provocando el proceso necesario en los electrodos. Las leyes de Faraday no se aplican a la electrólisis de gases. Estas condiciones son necesarias para su realización:
- Ni la alta tensión ni la alta corriente pueden ayudar sin una ionización artificial del gas.
- Sólo los ácidos gaseosos sin oxígeno y ciertos gases son adecuados para la electrólisis.
¡Importante! El proceso procederá de forma similar a la electrólisis en un electrolito líquido si se cumplen las condiciones necesarias.
Características de los procesos que tienen lugar en el cátodo y el ánodo
Para la aplicación práctica de la electrólisis, es importante entender lo que ocurre en ambos electrodos cuando se aplica una corriente eléctrica. Los siguientes procesos son característicos:
- Cátodo. Los iones cargados positivamente se precipitan hacia él. Aquí se produce la reducción de los metales o la liberación de hidrógeno. Se pueden distinguir varias categorías de metales según su actividad catiónica. Los metales como el Li, K, Ba, St, Ca, Na, Mg, Be, Al sólo se reducen bien a partir de las sales fundidas. Si se utiliza una solución, se libera hidrógeno mediante la electrólisis del agua. Los siguientes metales pueden recuperarse en solución, pero con una concentración suficiente de cationes - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. El proceso es más fácil para Ag, Cu, Bi, Pt, Au, Hg.
- Ánodo. A este electrodo llegan iones con carga negativa. Al oxidarse, quitan electrones al metal, lo que conduce a su disolución anódica, es decir Los aniones se convierten en iones con carga positiva, que se dirigen hacia el cátodo. Los aniones también se subdividen según su actividad. Sólo los aniones PO4, CO3, SO4, NO3, NO2, ClO4, F pueden salir de los fundidos. En las soluciones acuosas, no se someten a la electrólisis, sino al agua con la liberación de oxígeno. Los aniones como OH, Cl, I, S y Br son los que más fácilmente reaccionan.

A la hora de realizar la electrólisis, es importante tener en cuenta la tendencia a la oxidación del material del electrodo. Se distingue entre ánodos inertes y activos. Los electrodos inertes son de grafito, carbono o platino y no intervienen en el suministro de iones.
Factores que afectan al proceso de electrólisis
El proceso de electrólisis depende de los siguientes factores
- La composición del electrolito. Las diferentes impurezas ejercen una influencia significativa. Se dividen en 3 tipos: cationes, aniones y orgánicos. Las sustancias pueden ser más o menos negativas que el metal base, y esto interfiere en el proceso. Entre las impurezas orgánicas hay contaminantes (por ejemplo, aceites) y tensioactivos. Sus concentraciones están en los valores máximos permitidos.
- Densidad de corriente. De acuerdo con la ley de Faraday, la masa de la sustancia depositada aumenta con la fuerza de la corriente. Sin embargo, se dan circunstancias desfavorables: polarización concentrada, aumento de la tensión, calentamiento intenso del electrolito. Teniendo en cuenta esto, hay valores óptimos para la densidad de corriente en cada caso.
- pH del electrolito. La acidez del medio también se selecciona teniendo en cuenta los metales. Por ejemplo, el pH óptimo para el zinc es de 140 g/cc.
- Temperatura del electrolito. Esto tiene un efecto ambiguo. A medida que aumenta la temperatura, aumenta la velocidad de electrólisis, pero también la actividad de las impurezas. Hay una temperatura óptima para cada proceso. Suele estar entre 38 y 45 grados.
¡Importante! La electrólisis puede acelerarse o ralentizarse por diferentes influencias y por la elección de la composición del electrolito. Para cada aplicación existe un régimen diferente que debe respetarse estrictamente.
¿Dónde se utiliza la electrólisis?
La electrólisis se utiliza en muchas aplicaciones. Hay varios usos principales que se pueden distinguir para obtener resultados prácticos.
Galvanoplastia
Se pueden aplicar revestimientos metálicos finos y resistentes por electrólisis. El artículo recubierto se coloca en un baño como cátodo y el electrolito contiene una sal del metal deseado. Así se puede recubrir el acero con zinc, cromo o estaño.

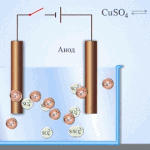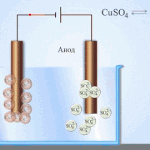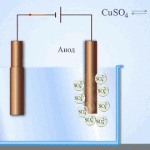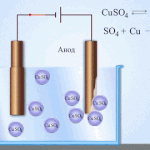
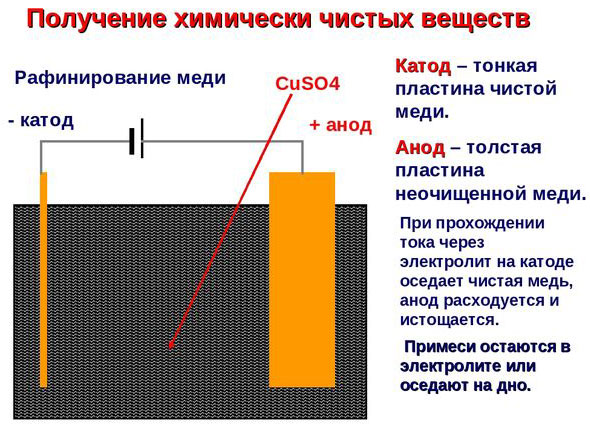
Electro-refinación - refinación de cobre
Un ejemplo de proceso de electrotratamiento sería cátodo - cobre puro ánodo - cobre con impurezas, electrolito - solución acuosa de sulfato de cobre. El cobre del ánodo se convierte en iones y se deposita en el cátodo sin impurezas.
Extracción de metales
Para extraer los metales de las sales, los metales se funden y luego se electrolizan en la masa fundida. Este proceso es bastante eficaz en la recuperación de aluminio a partir de bauxita, sodio y potasio.

Anodizado
En este proceso, el revestimiento se hace con compuestos no metálicos. El ejemplo clásico es el anodizado del aluminio. La parte de aluminio se monta como un ánodo. El electrolito es una solución de ácido sulfúrico. Como resultado de la electrólisis, se deposita una capa de óxido de aluminio en el ánodo, que tiene propiedades protectoras y decorativas. Estas tecnologías se utilizan ampliamente en diferentes industrias. También es posible realizar los procesos con sus propias manos y de forma segura.
Costes energéticos
La electrólisis requiere una gran cantidad de energía. El proceso tendrá valor práctico si la corriente anódica es suficiente, lo que requiere que se aplique una corriente continua importante desde la fuente de alimentación. Además, produce pérdidas de tensión laterales: sobretensiones anódicas y catódicas, y pérdidas en el electrolito debido a su resistencia. La eficiencia de una planta se determina relacionando la potencia de la entrada de energía con la unidad de masa útil de la sustancia obtenida.
La electrólisis se utiliza desde hace tiempo en la industria con gran eficacia. El anodizado y la galvanoplastia se han convertido en algo habitual en la vida cotidiana, y la extracción y el procesamiento de materiales ayudan a extraer muchos metales del mineral. El proceso se puede planificar y calcular conociendo sus patrones básicos.
Artículos relacionados: