Otázka, co je to elektrolýza, se probírá už od školních hodin fyziky a pro většinu lidí není žádným tajemstvím. Další věcí je jeho význam a praktické využití. Tento postup se s výhodou používá v různých průmyslových odvětvích a může se hodit i domácím kutilům.
Obsah
Co je elektrolýza?
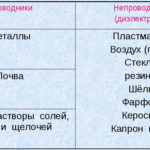
Elektrolýza je komplex specifických procesů v systému elektrody a elektrolytu, kterým protéká stálý elektrický proud. Jeho mechanismus je založen na generování iontového proudu. Elektrolyt je vodič typu 2 (iontová vodivost), ve kterém dochází k elektrolytické disociaci. To zahrnuje rozklad na ionty s kladným (kation) a záporné (anion).
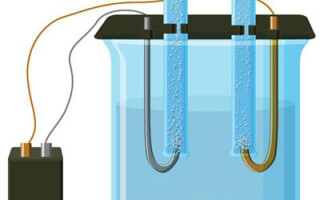
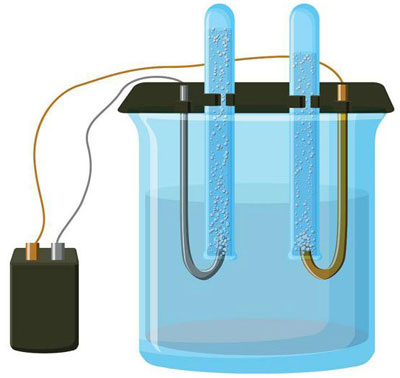
Systém elektrolýzy nutně obsahuje kladný (anoda) a záporný (katoda) elektrody. Při použití stejnosměrného elektrického proudu se kationty pohybují směrem ke katodě a anionty směrem k anodě. Kationty jsou především ionty kovů a vodík a anionty kyslík a chlor. Na katodě získávají kationty přebytečné elektrony, čímž je umožněna redukční reakce Men+ + ne → Me (kde n je valence kovu). Na anodě se naopak elektrony vracejí z aniontu a probíhá oxidační reakce.
Tím je v systému zajištěn redoxní proces. Důležité však je, že tento proces vyžaduje energii. Ten musí být zajištěn externím zdrojem proudu.
Faradayovy zákony elektrolýzy
Velký fyzik M. Faraday svým výzkumem umožnil nejen pochopit podstatu elektrolýzy, ale také provést výpočty nezbytné pro její realizaci. V roce 1832 se objevily jeho zákony, které spojovaly hlavní parametry probíhajících procesů.
První zákon
První Faradayův zákon říká, že hmotnost látky redukované na anodě je přímo úměrná elektrickému náboji indukovanému v elektrolytu: m = kq = k*I*t, kde q je náboj, k je koeficient nebo elektrochemický ekvivalent látky, I je proud protékající elektrolytem a t je doba průtoku proudu.

Druhý zákon
Druhý Faradayův zákon umožnil určit koeficient úměrnosti k. Platí, že elektrochemický ekvivalent jakékoli látky je přímo úměrný její molární hmotnosti a nepřímo úměrný její valenci. Zákon je vyjádřen ve tvaru:

k = 1/F*A/zkde F je Faradayova konstanta, A je molární hmotnost látky a z je její chemická valence.
S přihlédnutím k oběma zákonům můžeme odvodit konečný vzorec pro výpočet hmotnosti látky usazené na elektrodě: m = A*I*t/(n*F)kde n je počet elektronů zapojených do elektrolýzy. Obvykle n odpovídá náboji iontu. Z praktického hlediska je důležité vztahovat hmotnost látky k aplikovanému proudu, což umožňuje řídit proces změnou jeho síly.
Elektrolýza tavenin
Jednou z variant elektrolýzy je použití taveniny jako elektrolytu. V tomto případě se elektrolytického procesu účastní pouze ionty taveniny. Klasickým příkladem je elektrolýza taveniny soli NaCl (kuchyňská sůl). Záporné ionty proudí k anodě, což znamená, že se uvolňuje plyn (Cl). Na katodě dojde k redukci kovu, tj. k usazování čistého Na, který vzniká z kladných iontů, jež přitáhly přebytečné elektrony. Podobným způsobem lze vyrábět i jiné kovy (K, Ca, Li atd.) z rozpouštění příslušných solí.
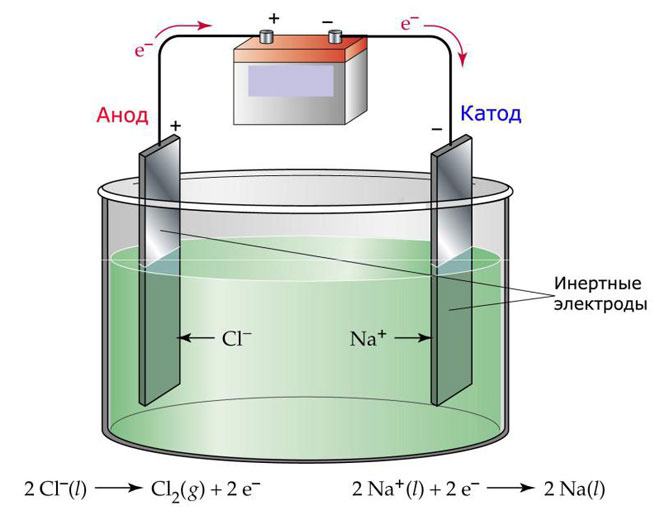
Při elektrolýze v roztaveném stavu se elektrody nerozpouštějí, ale slouží pouze jako zdroj proudu. Při jejich výrobě lze použít kov, grafit a některé polovodiče. Je důležité, aby materiál měl dostatečnou vodivost. Jedním z nejběžnějších materiálů je měď.
Vlastnosti elektrolýzy v roztocích
Elektrolýza ve vodném roztoku se od elektrolýzy taveniny značně liší. Zde probíhají tři konkurenční procesy: oxidace vody za vzniku kyslíku, oxidace aniontu a anodické rozpouštění kovu. Proces zahrnuje ionty vody, elektrolyt a anodu. V souladu s tím může na katodě probíhat redukce vodíku, kationtů elektrolytu a kovu anody.

Schopnost těchto konkurenčních procesů závisí na elektrickém potenciálu systému. Proběhne pouze proces, který vyžaduje méně vnější energie. Kationty s nejvyšším elektrodovým potenciálem se tedy budou redukovat na katodě a anionty s nejnižším potenciálem se budou oxidovat na anodě. Elektrodový potenciál vodíku se považuje za "0". Například v draslíku se rovná (-2,93 В), sodík je (-2,71 В), olovo (-0,13 В) a pro stříbro je to (+0,8 В).
Elektrolýza v plynech
Plyn může působit jako elektrolyt pouze tehdy, je-li přítomen ionizátor. V tomto případě protéká ionizovaným prostředím proud, který vyvolává potřebné procesy na elektrodách. Faradayovy zákony neplatí pro elektrolýzu plynu. Tyto podmínky jsou nezbytné pro jeho realizaci:
- Bez umělé ionizace plynu nepomůže ani vysoké napětí, ani vysoký proud.
- Pro elektrolýzu jsou vhodné pouze plynné kyseliny bez obsahu kyslíku a některé plyny.
Důležité! Proces funguje podobně jako elektrolýza v kapalném elektrolytu, pokud jsou splněny potřebné podmínky.
Vlastnosti procesů probíhajících na katodě a anodě
Pro praktické využití elektrolýzy je důležité pochopit, co se děje na obou elektrodách při přivedení elektrického proudu. Charakteristické jsou následující procesy:
- Katoda. Kladně nabité ionty se k němu řítí. Zde dochází k redukci kovů nebo uvolňování vodíku. Podle kationtové aktivity lze rozlišit několik kategorií kovů. Kovy jako Li, K, Ba, St, Ca, Na, Mg, Be, Al se dobře redukují pouze z roztavených solí. Při použití roztoku se vodík uvolňuje elektrolýzou vody. Následující kovy lze získat v roztoku, avšak při dostatečné koncentraci kationtů - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Tento proces je nejjednodušší pro Ag, Cu, Bi, Pt, Au, Hg.
- Anoda. Na tuto elektrodu se přivádějí záporně nabité ionty. Při oxidaci odebírají kovu elektrony, což vede k jejich anodickému rozpouštění, tj. Aniony se přemění na kladně nabité ionty, které směřují ke katodě. Anionty se také dělí podle své aktivity. Z tavenin se mohou uvolňovat pouze anionty PO4, CO3, SO4, NO3, NO2, ClO4, F. Ve vodných roztocích nepodléhají elektrolýze, ale voda se z nich uvolňuje kyslík. Nejsnáze reagují anionty jako OH, Cl, I, S a Br.

Při elektrolýze je důležité vzít v úvahu sklon materiálu elektrody k oxidaci. Rozlišují se inertní a aktivní anody. Inertní elektrody jsou vyrobeny z grafitu, uhlíku nebo platiny a nepodílejí se na dodávce iontů.
Faktory ovlivňující proces elektrolýzy
Proces elektrolýzy závisí na následujících faktorech
- Složení elektrolytu. Významný vliv mají různé nečistoty. Ty se dělí na 3 typy - kationty, anionty a organické látky. Látky mohou být více nebo méně negativní než základní kov, což narušuje proces. Mezi organické nečistoty patří znečišťující látky (např. oleje) a povrchově aktivní látky. Jejich koncentrace jsou na maximálních přípustných hodnotách.
- Hustota proudu. V souladu s Faradayovým zákonem se hmotnost usazené látky zvyšuje se silou proudu. Vznikají však nepříznivé okolnosti - koncentrovaná polarizace, zvýšené napětí, intenzivní zahřívání elektrolytu. S ohledem na to existují v každém případě optimální hodnoty proudové hustoty.
- pH elektrolytu. Kyselost média je rovněž zvolena s ohledem na kovy. Například optimální pH pro zinek je 140 g/cc.
- Teplota elektrolytu. To má nejednoznačný účinek. Se zvyšující se teplotou se zvyšuje rychlost elektrolýzy, ale také aktivita nečistot. Pro každý proces existuje optimální teplota. Obvykle se pohybuje mezi 38 a 45 stupni.
Důležité! Elektrolýzu lze urychlit nebo zpomalit různými vlivy a volbou složení elektrolytu. Pro každou aplikaci platí jiný režim, který musí být přísně dodržován.
Kde se elektrolýza používá?
Elektrolýza se používá v mnoha aplikacích. Pro praktické výsledky lze rozlišit několik hlavních způsobů použití.
Galvanické pokovování
Elektrolýzou lze nanést tenký, odolný galvanický kovový povlak. Potažený předmět se umístí do lázně jako katoda a elektrolyt obsahuje sůl požadovaného kovu. Takto můžete ocel pokovit zinkem, chromem nebo cínem.

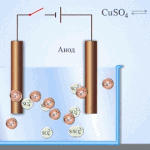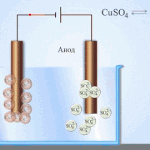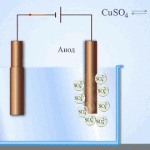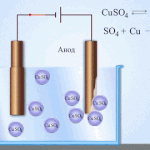
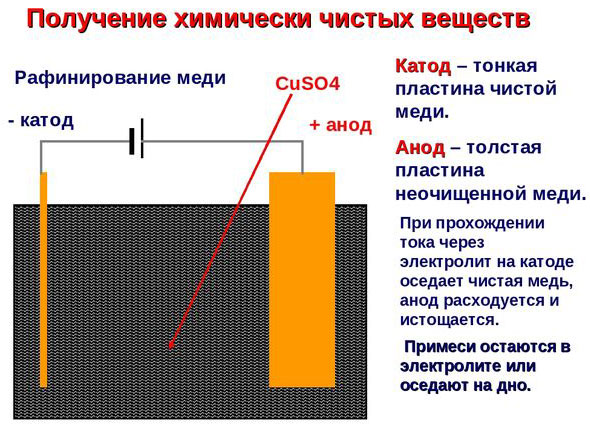
Elektrorafinace - rafinace mědi
Příkladem procesu elektroúpravy může být. katoda - čistá měď anoda - měď s nečistotami, elektrolyt - vodný roztok síranu měďnatého. Měď z anody se mění na ionty a usazuje se v katodě bez jakýchkoli nečistot.
Extrakce kovů
Při extrakci kovů ze solí se kovy taví a poté se v tavenině elektrolyzují. Tento proces je poměrně účinný při získávání hliníku z bauxitu, sodíku a draslíku.

Eloxování
Při tomto procesu se povlak vyrábí z nekovových sloučenin. Klasickým příkladem je eloxování hliníku. Hliníková část je namontována jako anoda. Elektrolytem je roztok kyseliny sírové. V důsledku elektrolýzy se na anodě usazuje vrstva oxidu hlinitého, která má ochranné a dekorativní vlastnosti. Výše uvedené technologie jsou široce využívány v různých průmyslových odvětvích. Procesy je možné provádět také vlastníma rukama a bezpečným způsobem.
Náklady na energii
Elektrolýza vyžaduje velké množství energie. Tento proces bude mít praktický význam, pokud bude anodický proud dostatečný, což vyžaduje, aby byl ze zdroje energie přiveden značný stejnosměrný proud. Kromě toho vznikají vedlejší napěťové ztráty - anodické a katodické přepětí a ztráty v elektrolytu v důsledku jeho odporu. Účinnost zařízení se určuje vztažením příkonu energie k jednotce užitečné hmotnosti získané látky.
Elektrolýza se již dlouho používá v průmyslu s vysokou účinností. Eloxování a galvanické pokovování se staly běžnou součástí každodenního života a těžba a zpracování materiálů pomáhá získat mnoho kovů z rudy. Proces lze naplánovat a vypočítat na základě znalosti jeho základních zákonitostí.
Související články: