الیکٹرولائسز کیا ہے اس سوال کو ہائی اسکول فزکس کورس کے ابتدائی طور پر حل کیا جاتا ہے، اور یہ زیادہ تر لوگوں کے لیے کوئی راز نہیں ہے۔ دوسری چیز اس کی اہمیت اور عملی اطلاق ہے۔ یہ عمل مختلف صنعتوں میں بڑے فائدے کے ساتھ استعمال ہوتا ہے اور گھریلو کاریگر کے لیے مفید ثابت ہو سکتا ہے۔
مشمولات
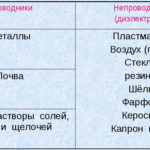
الیکٹرولیسس کیا ہے؟
الیکٹرولیسس الیکٹروڈ اور الیکٹرولائٹ کے نظام میں مخصوص عمل کا ایک پیچیدہ ہے جب اس کے ذریعے براہ راست برقی رو بہہ جاتا ہے۔ اس کا طریقہ کار آئنک کرنٹ کی نسل پر مبنی ہے۔ الیکٹرولائٹ ایک قسم 2 کنڈکٹر ہے (آئنک چالکتا) جس میں الیکٹرولائٹک انحطاط واقع ہوتا ہے۔ اس میں مثبت کے ساتھ آئنوں میں گلنا شامل ہے (کیشن) اور منفی (anion) چارج.
ایک الیکٹرولائٹک نظام میں لازمی طور پر ایک مثبت (اینوڈ) اور ایک منفی (کیتھوڈ) الیکٹروڈ۔ جب براہ راست برقی رو لگائی جاتی ہے تو کیشنز کیتھوڈ کی طرف بڑھنا شروع ہو جاتے ہیں اور اینونز انوڈ کی طرف بڑھتے ہیں۔کیشنز بنیادی طور پر دھاتی آئن اور ہائیڈروجن ہیں، اور آئن آکسیجن اور کلورین ہیں۔ کیتھوڈ پر، کیشنز اضافی الیکٹرانوں کو اپنے ساتھ جوڑتے ہیں، جس سے Reduction Reaction Men+ + ne → Me (جہاں n دھات کی والینس ہے۔)۔ انوڈ پر، اس کے برعکس، الیکٹرانوں کو آکسیڈیٹیو رد عمل کے ساتھ ایون سے چھوڑ دیا جاتا ہے۔
اس طرح، نظام میں ریڈوکس عمل کو یقینی بنایا جاتا ہے۔ یہ ذہن میں رکھنا ضروری ہے کہ ایسا ہونے کے لیے مناسب توانائی کی ضرورت ہوتی ہے۔ اسے کسی بیرونی موجودہ ذریعہ سے فراہم کیا جانا چاہیے۔
فیراڈے کے الیکٹرولیسس کے قوانین
عظیم طبیعیات دان ایم فیراڈے نے اپنی تحقیق کے ذریعے نہ صرف الیکٹرولائسز کی نوعیت کو سمجھنا بلکہ اس کے نفاذ کے لیے ضروری حساب کتاب کرنا بھی ممکن بنایا۔ 1832 میں اس کے قوانین نمودار ہوئے، جو ہونے والے عمل کے اہم پیرامیٹرز کو جوڑتے تھے۔
پہلا قانون
فیراڈے کا پہلا قانون یہ بتاتا ہے کہ انوڈ پر کم ہونے والے مادے کی کمیت الیکٹرولائٹ میں پیدا ہونے والے برقی چارج کے براہ راست متناسب ہے: m = kq = k*I*t، جہاں q چارج ہے، k اس کا گتانک یا الیکٹرو کیمیکل مساوی ہے مادہ، I الیکٹرولائٹ کے ذریعے بہنے والا کرنٹ ہے، t کرنٹ کے بہاؤ کا وقت ہے۔

دوسرا قانون
فیراڈے کے دوسرے قانون نے تناسب k کے عدد کا تعین کرنا ممکن بنایا۔ یہ اس طرح پڑھتا ہے: کسی بھی مادے کا الیکٹرو کیمیکل مساوی اس کے داڑھ کے بڑے پیمانے پر براہ راست متناسب ہوتا ہے اور اس کی والینس کے الٹا متناسب ہوتا ہے۔ قانون کا اظہار اس طرح کیا گیا ہے:

k = 1/F*A/zجہاں F فیراڈے کا مستقل ہے، A مادہ کا داڑھ ماس ہے، z اس کا کیمیائی توازن ہے۔
دونوں قوانین کو مدنظر رکھتے ہوئے، ہم الیکٹروڈ پر جمع ہونے والے مادے کی کمیت کا حساب لگانے کے لیے حتمی فارمولہ اخذ کر سکتے ہیں: m = A*I*t/(n*F)جہاں n الیکٹرولیسز میں شامل الیکٹرانوں کی تعداد ہے۔ عام طور پر n آئن کے چارج سے مطابقت رکھتا ہے۔عملی نقطہ نظر سے، یہ ضروری ہے کہ مادہ کے بڑے پیمانے کو موجودہ فراہم کردہ سے منسلک کیا جائے، جو اس کی طاقت کو تبدیل کرکے عمل کو کنٹرول کرنا ممکن بناتا ہے۔
پگھلنے کا الیکٹرولیسس
الیکٹرولیسس کا ایک آپشن یہ ہے کہ پگھلنے کو الیکٹرولائٹ کے طور پر استعمال کیا جائے۔ اس صورت میں، صرف پگھلنے والے آئن ہی الیکٹرولیسس کے عمل میں شامل ہوتے ہیں۔ ایک بہترین مثال نمک پگھلنے والے NaCl کا برقی تجزیہ ہے (کھانے کا نمک)۔ منفی آئن انوڈ کی طرف بڑھتے ہیں، جس کا مطلب ہے کہ گیس خارج ہوتی ہے (کل)۔ کیتھوڈ میں دھات کی کمی ہوگی، یعنی خالص نا کا آباد ہونا مثبت آئنوں سے بنتا ہے جس نے اضافی الیکٹرانوں کو اپنی طرف متوجہ کیا۔ اسی طرح دیگر دھاتیں بھی پیدا کی جا سکتی ہیں (K، Ca، Li، وغیرہ) متعلقہ نمکیات کے پگھلنے سے۔
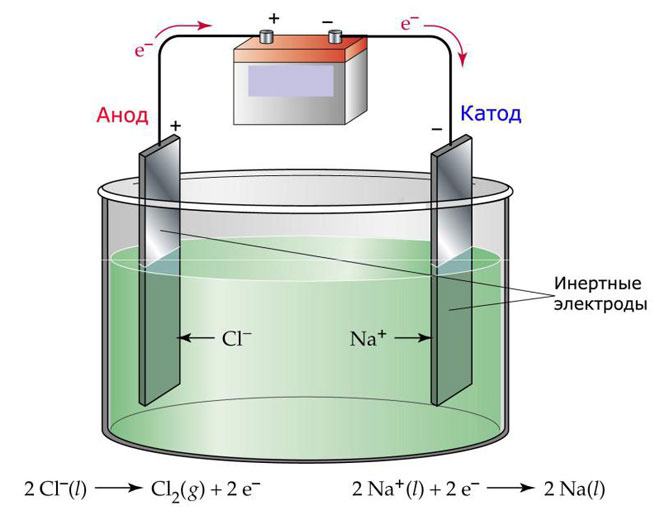
پگھلنے میں الیکٹرولیسس کے دوران، الیکٹروڈ تحلیل نہیں ہوتے ہیں لیکن صرف ایک موجودہ ذریعہ کے طور پر حصہ لیتے ہیں. ان کی تیاری میں دھات، گریفائٹ اور کچھ سیمی کنڈکٹرز استعمال کیے جا سکتے ہیں۔ یہ ضروری ہے کہ مواد میں کافی چالکتا ہو۔ سب سے زیادہ عام مواد میں سے ایک تانبا ہے.
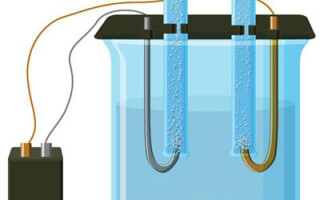
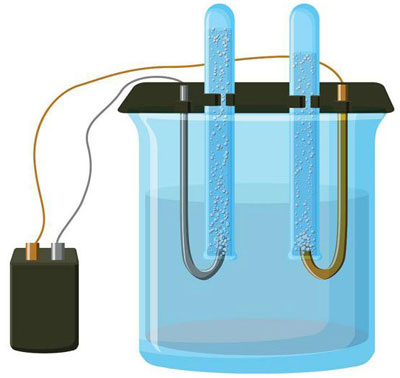
حل میں الیکٹرولیسس کی خصوصیات
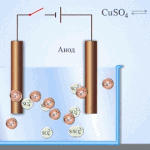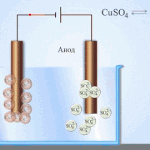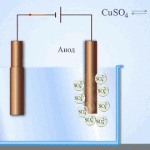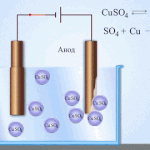
پانی کے محلول میں الیکٹرولیسس پگھلنے سے بالکل مختلف ہے۔ 3 مسابقتی عمل ہیں: آکسیجن کے اخراج کے ساتھ پانی کا آکسیکرن، آئنون کا آکسیکرن اور دھات کی اینوڈک تحلیل۔ اس عمل میں پانی کے آئن، الیکٹرولائٹ اور انوڈ شامل ہیں۔ اس کے مطابق، کیتھوڈ میں ہائیڈروجن، الیکٹرولائٹ کیشنز، اور اینوڈ دھات کی کمی واقع ہوسکتی ہے۔

ان مسابقتی عمل کے ہونے کی صلاحیت نظام کی برقی صلاحیتوں پر منحصر ہے۔ صرف وہی عمل آگے بڑھے گا جس میں کم بیرونی توانائی کی ضرورت ہوتی ہے۔ نتیجتاً، کیتھوڈ پر زیادہ سے زیادہ الیکٹروڈ پوٹینشل کے ساتھ کیشنز کم ہو جائیں گے، اور سب سے کم پوٹینشل والے اینونز انوڈ پر آکسائڈائز ہو جائیں گے۔ ہائیڈروجن کے الیکٹروڈ پوٹینشل کو "0" کے طور پر لیا جاتا ہے۔ مثال کے طور پر، پوٹاشیم میں یہ برابر ہے (-2,93 В)، سوڈیم برابر ہے (-2,71 Вلیڈ (-0,13 В)، اور چاندی کے لیے - (+0,8 В).
گیسوں میں الیکٹرولیسس
ایک گیس صرف ionizer کی موجودگی میں ایک الیکٹرولائٹ کا کردار ادا کر سکتی ہے۔ اس صورت میں، آئنائزڈ میڈیم سے گزرنے والا کرنٹ الیکٹروڈز پر ضروری عمل کا سبب بنتا ہے۔ فیراڈے کے قوانین گیس الیکٹرولیسس پر لاگو نہیں ہوتے ہیں۔ اس کے حصول کے لیے ایسی شرائط ضروری ہیں:
- گیس کے مصنوعی آئنائزیشن کے بغیر، نہ تو ہائی وولٹیج اور نہ ہی زیادہ کرنٹ مدد کرے گا۔
- گیسی حالت میں صرف آکسیجن سے پاک تیزاب اور کچھ گیسیں برقی تجزیہ کے لیے موزوں ہیں۔
اہم! اگر ضروری شرائط پوری ہو جائیں تو یہ عمل مائع الیکٹرولائٹ میں الیکٹرولیسس کی طرح آگے بڑھتا ہے۔
کیتھوڈ اور انوڈ پر ہونے والے عمل کی خصوصیات
برقی تجزیہ کے عملی اطلاق کے لیے، یہ سمجھنا ضروری ہے کہ جب برقی رو لگائی جاتی ہے تو دونوں الیکٹروڈز پر کیا ہوتا ہے۔ مندرجہ ذیل عمل خصوصیت ہیں:
- کیتھوڈ۔ مثبت چارج شدہ آئن اس کی طرف بڑھتے ہیں۔ یہ وہ جگہ ہے جہاں دھاتوں کی کمی یا ہائیڈروجن کا اخراج ہوتا ہے۔ دھاتوں کی کئی اقسام کو ان کی کیشنک سرگرمی کے مطابق پہچانا جا سکتا ہے۔ دھاتیں جیسے Li, K, Ba, St, Ca, Na, Mg, Be, Al صرف پگھلے ہوئے نمکیات سے اچھی طرح سے کم ہوتی ہیں۔ اگر کوئی محلول استعمال کیا جائے تو پانی کے الیکٹرولیسس کی وجہ سے ہائیڈروجن خارج ہوتی ہے۔ حل میں کمی فراہم کرنا ممکن ہے، لیکن کیشنز کی کافی ارتکاز کے ساتھ، درج ذیل دھاتوں میں - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb۔ یہ عمل Ag, Cu, Bi, Pt, Au, Hg کے لیے سب سے آسان ہے۔
- انوڈ اس الیکٹروڈ پر منفی چارج شدہ آئن آتے ہیں۔ ان کو آکسائڈائز کرتے ہوئے، وہ الیکٹرانوں کو دھات سے دور لے جاتے ہیں، جو ان کے انوڈک تحلیل کا باعث بنتے ہیں، یعنی ایونز مثبت چارج شدہ آئنوں میں تبدیل ہو جاتے ہیں، جن کا رخ کیتھوڈ کی طرف ہوتا ہے۔ Anions کو بھی ان کی سرگرمی کے مطابق ذیلی تقسیم کیا جاتا ہے۔ صرف PO4, CO3, SO4, NO3, NO2, ClO4, F anions کو پگھلنے سے خارج کیا جا سکتا ہے۔ پانی کے محلول میں، وہ الیکٹرولیسس کا نشانہ نہیں بنتے ہیں، لیکن آکسیجن کی رہائی کے ساتھ پانی. Anions جیسے OH, Cl, I, S, Br سب سے زیادہ آسانی سے رد عمل ظاہر کرتے ہیں۔

الیکٹرولیسس فراہم کرتے وقت، الیکٹروڈ مواد کے آکسائڈائز کرنے کے رجحان پر غور کرنا ضروری ہے. اس سلسلے میں، غیر فعال اور فعال anodes ممتاز ہیں. غیر فعال الیکٹروڈ گریفائٹ، کوئلے یا پلاٹینم سے بنے ہیں اور آئنوں کی فراہمی میں شامل نہیں ہیں۔
الیکٹرولیسس کے عمل کو متاثر کرنے والے عوامل
الیکٹرولیسس کا عمل درج ذیل عوامل پر منحصر ہے:
- الیکٹرولائٹ کی ترکیب. ایک اہم اثر مختلف نجاستوں سے ہوتا ہے۔ انہیں 3 اقسام میں تقسیم کیا گیا ہے - کیشنز، اینونس اور آرگینکس۔ مادہ بیس میٹل سے کم یا زیادہ منفی ہو سکتا ہے، جو عمل میں مداخلت کرتا ہے۔ نامیاتی نجاستوں میں آلودگی (مثلاً تیل) اور سرفیکٹینٹس شامل ہیں۔ ان کے ارتکاز کی قدریں محدود ہیں۔
- موجودہ کثافت. فیراڈے کے قوانین کے مطابق، جمع شدہ مادہ کی کمیت بڑھ جاتی ہے جیسے جیسے موجودہ طاقت بڑھتی ہے۔ تاہم، ناموافق حالات پیدا ہوتے ہیں - مرتکز پولرائزیشن، وولٹیج میں اضافہ، الیکٹرولائٹ کی شدید حرارت۔ اس کو ذہن میں رکھتے ہوئے، ہر کیس کے لیے موجودہ کثافت کی بہترین قدریں ہیں۔
- الیکٹرولائٹ کا پی ایچ. میڈیم کی تیزابیت کو بھی دھاتوں کو مدنظر رکھتے ہوئے منتخب کیا جاتا ہے۔ مثال کے طور پر، زنک کے لیے الیکٹرولائٹ کی تیزابیت کی زیادہ سے زیادہ قیمت 140 g/cc ہے۔
- الیکٹرولائٹ درجہ حرارت. اس کا ایک مبہم اثر ہے۔ جیسے جیسے درجہ حرارت بڑھتا ہے، الیکٹرولائسز کی شرح بڑھ جاتی ہے، لیکن اسی طرح نجاست کی سرگرمی بھی بڑھ جاتی ہے۔ ہر عمل کے لیے ایک بہترین درجہ حرارت ہے۔ یہ عام طور پر 38-45 ڈگری کے درمیان ہوتا ہے۔
اہم! مختلف اثرات اور الیکٹرولائٹ کمپوزیشن کے انتخاب سے الیکٹرولیسس کو تیز یا سست کیا جا سکتا ہے۔ ہر ایپلیکیشن کا اپنا موڈ ہوتا ہے، جس کا سختی سے مشاہدہ کیا جانا چاہیے۔
الیکٹرولیسس کہاں استعمال کیا جاتا ہے؟
الیکٹرولیسس بہت سے ایپلی کیشنز میں استعمال کیا جاتا ہے. عملی نتائج کے لیے کئی بڑے استعمال کی نشاندہی کی جا سکتی ہے۔
الیکٹروپلاٹنگ
دھات کی ایک پتلی، پائیدار گالوانک کوٹنگ الیکٹرولیسس کے ذریعے لگائی جا سکتی ہے۔لیپت ہونے والی چیز کو غسل خانے میں کیتھوڈ کے طور پر رکھا جاتا ہے، اور الیکٹرولائٹ میں مطلوبہ دھات کا نمک ہوتا ہے۔ اس طرح سٹیل کو زنک، کرومیم یا ٹن سے چڑھایا جا سکتا ہے۔

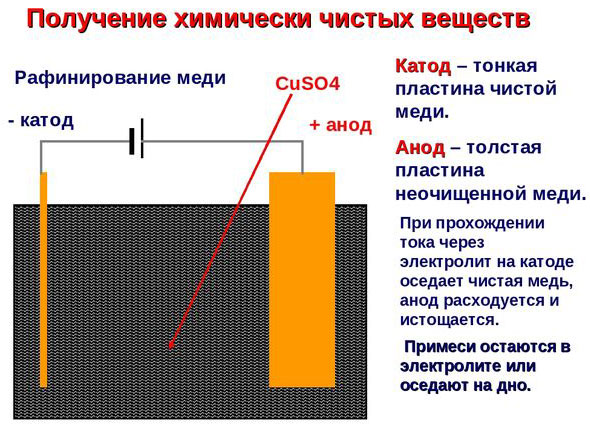
الیکٹرو ٹریٹمنٹ - تانبے کو صاف کرنا
الیکٹرک ریفائننگ کی ایک مثال یہ اختیار ہے: کیتھوڈ - خالص تانبا، اینوڈ - نجاست کے ساتھ تانبا، الیکٹرولائٹ - تانبے سلفیٹ کا پانی کا محلول۔ اینوڈ سے تانبا آئنوں میں بدل جاتا ہے اور بغیر کسی نجاست کے کیتھوڈ میں جمع ہوتا ہے۔
دھات نکالنا۔
نمکیات سے دھاتیں حاصل کرنے کے لیے انہیں ایک پگھلنے میں منتقل کیا جاتا ہے اور پھر اس میں الیکٹرولیسس فراہم کیا جاتا ہے۔ باکسائٹ، سوڈیم اور پوٹاشیم سے ایلومینیم حاصل کرنے کے لیے یہ طریقہ کافی موثر ہے۔

انوڈائزنگ
اس عمل میں، کوٹنگ غیر دھاتی مرکبات سے بنائی جاتی ہے۔ کلاسیکی مثال ایلومینیم انوڈائزنگ ہے۔ ایلومینیم کا حصہ اینوڈ کی طرح نصب ہے۔ الیکٹرولائٹ سلفورک ایسڈ کا حل ہے۔ الیکٹرولیسس کے نتیجے میں، ایلومینیم آکسائیڈ کی ایک تہہ اینوڈ پر جمع ہوتی ہے، جس میں حفاظتی اور آرائشی خصوصیات ہوتی ہیں۔ یہ ٹیکنالوجیز مختلف صنعتوں میں بڑے پیمانے پر استعمال ہوتی ہیں۔ محفوظ طریقے سے اپنے ہاتھوں سے عمل کو انجام دینا بھی ممکن ہے۔
توانائی کے اخراجات
الیکٹرولیسس میں بہت زیادہ توانائی کی ضرورت ہوتی ہے۔ یہ عمل عملی اہمیت کا حامل ہوگا اگر انوڈک کرنٹ کافی ہو، اور اس کے لیے برقی طاقت کے منبع سے کافی براہ راست کرنٹ لگانا ضروری ہے۔ اس کے علاوہ، یہ سائیڈ وولٹیج کے نقصانات پیدا کرتا ہے - انوڈک اور کیتھوڈک اوور وولٹیج، اس کی مزاحمت کی وجہ سے الیکٹرولائٹ میں ہونے والے نقصانات۔ پلانٹ کی کارکردگی کا تعین انرجی ان پٹ کی طاقت کو حاصل شدہ مادہ کے کارآمد ماس کی اکائی سے جوڑ کر کیا جاتا ہے۔
الیکٹرولیسس طویل عرصے سے صنعت میں اعلی کارکردگی کے ساتھ استعمال ہوتا رہا ہے۔ انوڈائزنگ اور الیکٹروپلاٹنگ روزمرہ کی زندگی میں عام ہو گئی ہے، اور مواد کی کان کنی اور فائدہ اٹھانے سے ایسک سے بہت سی دھاتیں نکالنے میں مدد ملتی ہے۔اس عمل کو اس کے بنیادی نمونوں کو جان کر منصوبہ بندی اور حساب لگایا جا سکتا ہے۔
متعلقہ مضامین: