È spesso un problema decidere quale elettrodo è il catodo e quale l'anodo. Un buon inizio è definire i termini.
Il concetto di catodo e anodo - una semplice spiegazione
Nelle sostanze complesse, gli elettroni tra gli atomi dei composti non sono equamente distribuiti. L'interazione fa sì che le particelle si spostino da un atomo di una sostanza a un atomo di un'altra. La reazione è chiamata reazione di ossido-riduzione. La perdita di elettroni è chiamata ossidazione, l'elemento che cede gli elettroni è chiamato riducente.
L'aggiunta di elettroni è chiamata riduzione, l'elemento che assume gli elettroni è chiamato ossidante. Il trasferimento di elettroni dal riducente all'ossidante può avvenire attraverso un circuito esterno, e quindi può essere utilizzato come fonte di energia elettrica. I dispositivi che convertono l'energia di una reazione chimica in energia elettrica sono chiamati cellule galvaniche.
L'esempio classico più semplice di una cella galvanica è costituito da due piastre fatte di metalli diversi e immerse in una soluzione elettrolitica. In questo sistema, l'ossidazione avviene su un metallo e la riduzione sull'altro.
IMPORTANTE! L'elettrodo dove avviene l'ossidazione è chiamato anodo. L'elettrodo dove avviene la riduzione è chiamato catodo.
Una cella galvanica rame-zinco, che funziona assorbendo l'energia della reazione tra zinco e solfato di rame, è un esempio familiare dai libri di testo di chimica scolastica. Nel dispositivo Jacoby-Daniel, una piastra di rame è posta in una soluzione di solfato di rame (elettrodo di rame) e una piastra di zinco è immersa in una soluzione di solfato di zinco (elettrodo di zinco). L'elettrodo di zinco emette cationi nella soluzione, creando un eccesso di carica positiva in essa, mentre all'elettrodo di rame la soluzione è impoverita di cationi, qui la soluzione è caricata negativamente.
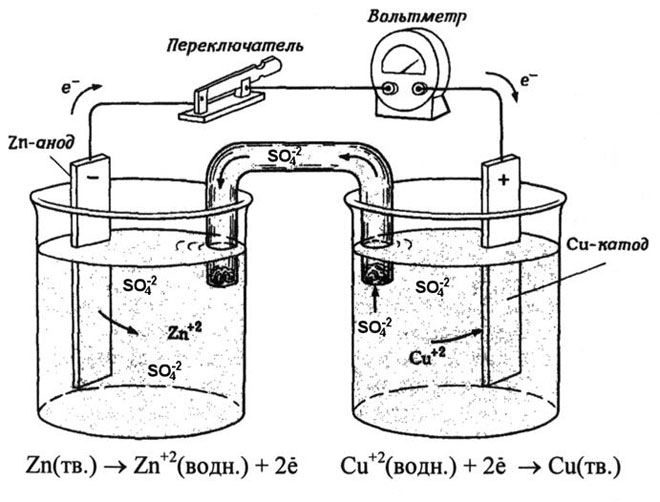
La chiusura del circuito esterno provoca il flusso di elettroni dall'elettrodo di zinco all'elettrodo di rame. Le relazioni di equilibrio ai confini di fase sono interrotte. Ha luogo una reazione redox.
L'energia della reazione chimica spontanea è convertita in energia elettrica.
Se la reazione chimica è provocata da energia elettrica esterna, si ha un processo chiamato elettrolisi. I processi che avvengono durante l'elettrolisi sono l'inverso di quelli che avvengono durante il funzionamento della cella galvanica.
ATTENZIONE! L'elettrodo, sul quale avviene la riduzione, si chiama anche catodo, ma nell'elettrolisi è caricato negativamente e l'anodo è caricato positivamente.
Applicazioni elettrochimiche
Anodi e catodi partecipano a molte reazioni chimiche:
- Elettrolisi;
- Elettroestrazione;
- Galvanotecnica;
- Galvanotecnica.
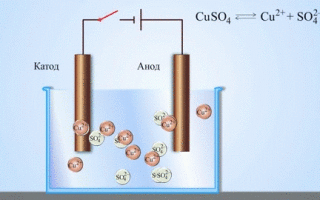
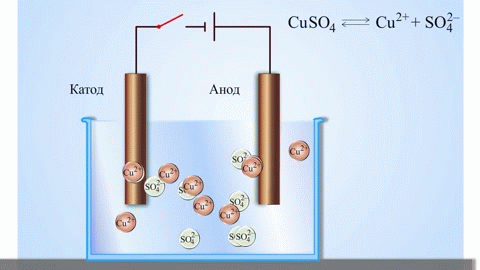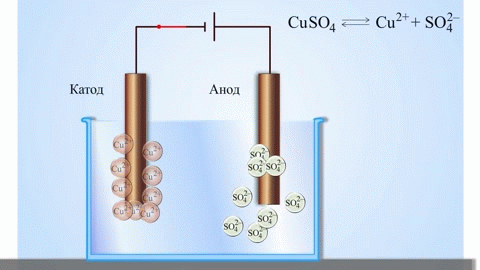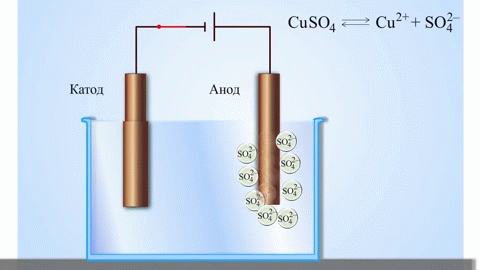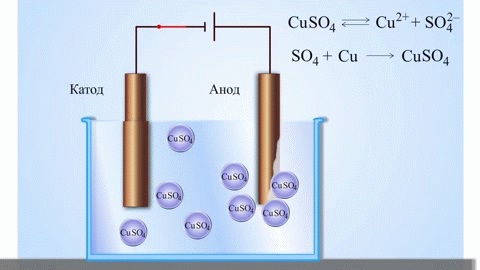
L'elettrolisi di composti fusi e soluzioni acquose produce metalli, purifica i metalli dalle impurità ed estrae componenti di valore (raffinazione elettrolitica). Le piastre sono fuse dal metallo da raffinare. Le piastre sono collocate come anodi nell'elettrolizzatore. Il metallo viene sciolto da una corrente elettrica. I suoi cationi passano nella soluzione e si scaricano al catodo, formando un precipitato di metallo puro. Le impurità contenute nella piastra metallica grezza originale o rimangono insolubili come fango anodico o passano nell'elettrolita dove vengono rimosse. Rame, nichel, piombo, oro, argento e stagno sono sottoposti a raffinazione elettrolitica.
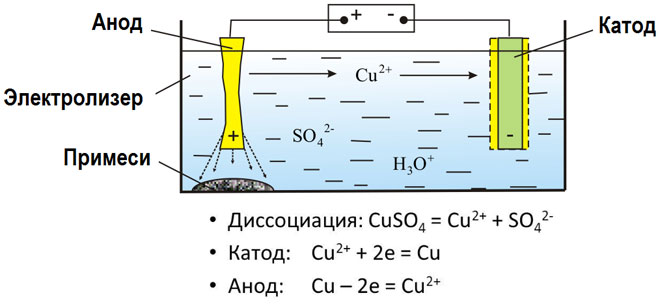
L'elettroestrazione è il processo di estrazione del metallo da una soluzione durante l'elettrolisi. Per trasferire il metallo in soluzione, viene trattato con reagenti speciali. Il processo separa il metallo di alta purezza al catodo. È così che si producono lo zinco, il rame e il cadmio.
Per evitare la corrosione, rendere il prodotto più forte e più decorativo, la superficie di un metallo è rivestita con un altro. Questo processo è chiamato galvanoplastica.

L'elettroformatura è il processo di fabbricazione di copie metalliche di oggetti tridimensionali mediante elettrodeposizione di metallo.

Applicazioni elettroniche sotto vuoto
Il principio del catodo e dell'anodo in un apparecchio a vuoto può essere dimostrato per mezzo di un tubo elettronico. Sembra un recipiente sigillato ermeticamente con parti metalliche all'interno. Il dispositivo è utilizzato per raddrizzare, generare e convertire segnali elettrici. Si fa una distinzione secondo il numero di elettrodi:
- diodi;
- triodi;
- tetrodi;
- pentodi ecc.
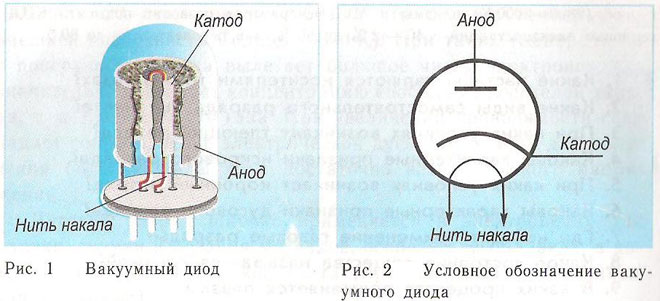
Un diodo è un dispositivo a vuoto con due elettrodi, un catodo e un anodo. Il catodo è collegato al polo negativo dell'alimentazione e l'anodo al polo positivo. Lo scopo del catodo è quello di emettere elettroni quando viene riscaldato da una corrente elettrica ad una certa temperatura. Gli elettroni sono usati per creare una carica spaziale tra il catodo e l'anodo. Gli elettroni più veloci corrono verso l'anodo, passando la barriera di potenziale negativo della carica spaziale. L'anodo riceve le particelle. La corrente anodica si crea nel circuito esterno. Il flusso di elettroni è controllato per mezzo di elettrodi supplementari che sono alimentati con un potenziale elettrico. I diodi sono utilizzati per convertire la corrente alternata in corrente continua.
Applicazioni elettroniche
Oggi si usano diodi a semiconduttore.
La proprietà dei diodi di far passare la corrente nel senso di marcia e di non farla passare nel senso inverso è ampiamente utilizzata in elettronica.
Il funzionamento di un LED si basa sulla proprietà dei cristalli semiconduttori di brillare quando si fa passare una corrente attraverso la giunzione p-n in direzione avanti.
Fonti galvaniche di corrente continua - batterie
Le fonti chimiche di corrente elettrica in cui avvengono reazioni reversibili sono chiamate batterie ricaricabili: si ricaricano e si usano ripetutamente.

Quando una batteria al piombo-acido funziona, avviene una reazione redox. Il piombo metallico si ossida e cede i suoi elettroni, riducendo il biossido di piombo che prende gli elettroni. Il piombo metallico nella batteria è l'anodo ed è caricato negativamente. Il biossido di piombo è il catodo ed è caricato positivamente.
Quando la batteria si scarica, le sostanze del catodo e dell'anodo e il loro elettrolita, l'acido solforico, si consumano. Per caricare la batteria, è collegata a una fonte di corrente (più a più, meno a meno). La direzione della corrente è ora l'opposto di quella che era quando la batteria era scarica. I processi elettrochimici agli elettrodi sono "invertiti". L'elettrodo di piombo diventa ora il catodo, dove avviene il processo di riduzione, e il biossido di piombo diventa l'anodo, dove avviene il processo di ossidazione. Le sostanze necessarie per la batteria vengono nuovamente create nella batteria.
Perché c'è confusione?
Il problema sorge perché un particolare segno di carica non può essere saldamente attaccato né all'anodo né al catodo. Spesso il catodo è l'elettrodo caricato positivamente e l'anodo è l'elettrodo negativo. Spesso, ma non sempre. Tutto dipende dal processo che avviene nell'elettrodo.
ATTENZIONE! Una parte che è stata messa nell'elettrolita può essere sia l'anodo che il catodo. Tutto dipende dallo scopo del processo: applicare un altro strato di metallo o rimuovere uno strato di metallo.
Come identificare l'anodo e il catodo
In elettrochimica, l'anodo è l'elettrodo dove avvengono i processi di ossidazione, il catodo è l'elettrodo dove avviene la riduzione.
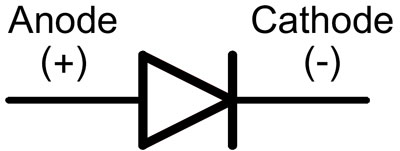
In un diodo, i conduttori sono chiamati anodo e catodo. La corrente scorrerà attraverso il diodo se il cavo anodico è collegato al "più" e il cavo catodico al "meno".
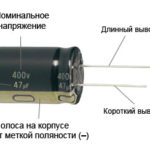
Per un nuovo LED con pin non tagliati, l'anodo e il catodo sono determinati visivamente dalla lunghezza. Il catodo è più corto.

Se i contatti sono tagliati, una batteria attaccata ad essi aiuterà. La luce apparirà quando le polarità corrispondono.
Il segno dell'anodo e del catodo
In elettrochimica, è più corretto parlare dei processi che avvengono sugli elettrodi invece dei segni degli elettrodi. La reazione di riduzione avviene sul catodo e la reazione di ossidazione avviene sull'anodo.
In ingegneria elettrica, il catodo è collegato al polo negativo della sorgente di corrente e l'anodo al polo positivo.
Articoli correlati: