Το ερώτημα τι είναι η ηλεκτρόλυση έχει συζητηθεί από το σχολικό μάθημα της φυσικής και δεν είναι μυστικό για τους περισσότερους ανθρώπους. Ένα άλλο πράγμα είναι η σημασία και η πρακτική εφαρμογή του. Αυτή η διαδικασία χρησιμοποιείται με μεγάλο πλεονέκτημα σε διάφορες βιομηχανίες και μπορεί να φανεί χρήσιμη στον οικιακό τεχνίτη.
Περιεχόμενα
- 1 Τι είναι η ηλεκτρόλυση;
- 2 Οι νόμοι του Faraday για την ηλεκτρόλυση
- 3 Ηλεκτρόλυση τήγματος
- 4 Χαρακτηριστικά της ηλεκτρόλυσης σε διαλύματα
- 5 Ηλεκτρόλυση σε αέρια
- 6 Χαρακτηριστικά των διεργασιών που λαμβάνουν χώρα στην κάθοδο και την άνοδο
- 7 Παράγοντες που επηρεάζουν τη διαδικασία ηλεκτρόλυσης
- 8 Πού εφαρμόζεται η ηλεκτρόλυση;
- 9 Ενεργειακό κόστος
Τι είναι η ηλεκτρόλυση;
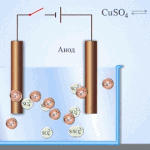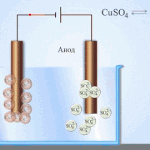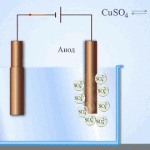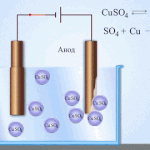
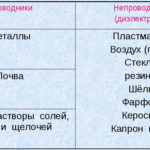
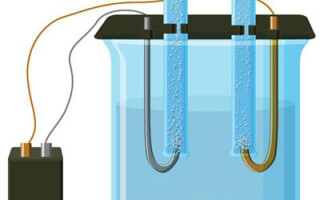
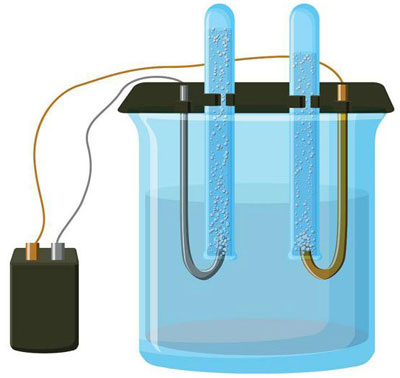
Η ηλεκτρόλυση είναι ένα σύμπλεγμα ειδικών διεργασιών σε ένα σύστημα ηλεκτροδίων και ηλεκτρολύτη με σταθερό ηλεκτρικό ρεύμα. Ο μηχανισμός του βασίζεται στη δημιουργία ιοντικού ρεύματος. Ο ηλεκτρολύτης είναι αγωγός τύπου 2 (ιοντική αγωγιμότητα) στην οποία λαμβάνει χώρα ηλεκτρολυτική διάσπαση. Αυτό περιλαμβάνει τη διάσπαση σε ιόντα με θετικό (cation) και αρνητικά (ανιόντα) χρέωση.
Ένα σύστημα ηλεκτρόλυσης περιέχει απαραίτητα ένα θετικό (άνοδος) και ένα αρνητικό (κάθοδος) ηλεκτρόδιο. Όταν εφαρμόζεται συνεχές ηλεκτρικό ρεύμα, τα κατιόντα κινούνται προς την κάθοδο και τα ανιόντα προς την άνοδο. Τα κατιόντα είναι κυρίως μεταλλικά ιόντα και υδρογόνο και τα ανιόντα είναι οξυγόνο και χλώριο. Στην κάθοδο, τα κατιόντα αποκτούν περίσσεια ηλεκτρονίων, επιτρέποντας έτσι την αντίδραση αναγωγής Men+ + ne → Me (όπου n είναι η σθένους του μετάλλου). Στην άνοδο, αντίθετα, τα ηλεκτρόνια επιστρέφονται από το ανιόν, με την αντίδραση οξείδωσης να λαμβάνει χώρα.
Έτσι, διασφαλίζεται η διαδικασία οξειδοαναγωγής στο σύστημα. Αυτό που είναι σημαντικό, ωστόσο, είναι ότι η διαδικασία απαιτεί ενέργεια. Αυτό πρέπει να παρέχεται από μια εξωτερική πηγή ρεύματος.
Οι νόμοι του Faraday για την ηλεκτρόλυση
Ο μεγάλος φυσικός M. Faraday όχι μόνο κατέστησε δυνατή με την έρευνά του την κατανόηση της φύσης της ηλεκτρόλυσης, αλλά και τους απαραίτητους υπολογισμούς για την εφαρμογή της. Το 1832 εμφανίστηκαν οι νόμοι του, οι οποίοι συνέδεαν τις κύριες παραμέτρους των διεργασιών που λάμβαναν χώρα.
Ο πρώτος νόμος
Ο πρώτος νόμος του Faraday ορίζει ότι η μάζα μιας ουσίας που ανάγεται στην άνοδο είναι ευθέως ανάλογη του ηλεκτρικού φορτίου που προκαλείται στον ηλεκτρολύτη: m = kq = k*I*t, όπου q είναι το φορτίο, k είναι ο συντελεστής ή το ηλεκτροχημικό ισοδύναμο της ουσίας, I είναι το ρεύμα που διαρρέει τον ηλεκτρολύτη και t είναι ο χρόνος ροής του ρεύματος.

Δεύτερος νόμος
Ο δεύτερος νόμος του Faraday επέτρεψε τον προσδιορισμό του συντελεστή αναλογικότητας k. Έχει ως εξής: το ηλεκτροχημικό ισοδύναμο οποιασδήποτε ουσίας είναι ευθέως ανάλογο της μοριακής μάζας της και αντιστρόφως ανάλογο του σθένους της. Ο νόμος εκφράζεται με τη μορφή:

k = 1/F*A/zόπου F είναι η σταθερά του Faraday, A είναι η μοριακή μάζα της ουσίας, z είναι η χημική της αξία.
Λαμβάνοντας υπόψη και τους δύο νόμους, μπορούμε να εξάγουμε τον τελικό τύπο για τον υπολογισμό της μάζας της ουσίας που εναποτίθεται στο ηλεκτρόδιο: m = A*I*t/(n*F)όπου n είναι ο αριθμός των ηλεκτρονίων που συμμετέχουν στην ηλεκτρόλυση. Συνήθως το n αντιστοιχεί στο φορτίο του ιόντος. Από πρακτική άποψη, είναι σημαντικό να συσχετιστεί η μάζα της ουσίας με το εφαρμοζόμενο ρεύμα, γεγονός που επιτρέπει τον έλεγχο της διαδικασίας με τη μεταβολή της ισχύος του.
Ηλεκτρόλυση τήγματος
Μια παραλλαγή της ηλεκτρόλυσης είναι η χρήση ενός τήγματος ως ηλεκτρολύτη. Στην περίπτωση αυτή μόνο τα ιόντα τήγματος συμμετέχουν στην ηλεκτρολυτική διαδικασία. Ένα κλασικό παράδειγμα είναι η ηλεκτρόλυση του τήγματος αλατιού NaCl (επιτραπέζιο αλάτι). Τα αρνητικά ιόντα σπεύδουν προς την άνοδο, πράγμα που σημαίνει ότι απελευθερώνεται αέριο (Cl). Στην κάθοδο θα υπάρξει αναγωγή του μετάλλου, δηλαδή καθίζηση του καθαρού Na, που σχηματίζεται από τα θετικά ιόντα, τα οποία έχουν προσελκύσει περίσσεια ηλεκτρονίων. Άλλα μέταλλα μπορούν να παραχθούν με παρόμοιο τρόπο (K, Ca, Li κ.λπ.) από τη διάλυση των αντίστοιχων αλάτων.
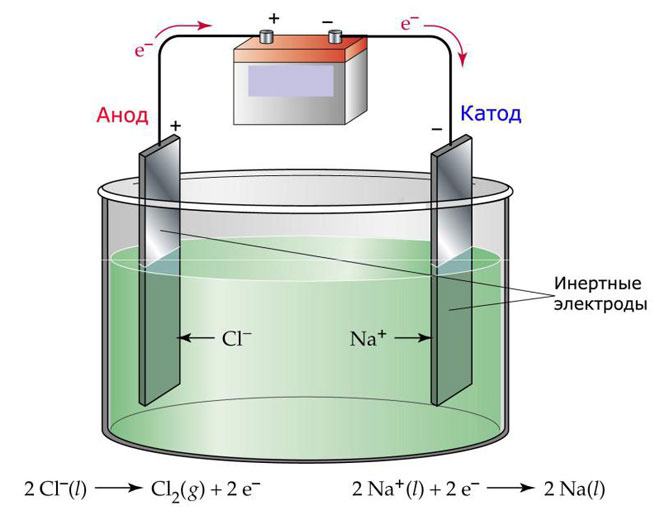
Στην ηλεκτρόλυση με τήγμα, τα ηλεκτρόδια δεν διαλύονται, αλλά συμμετέχουν μόνο ως πηγή ρεύματος. Για την κατασκευή τους μπορούν να χρησιμοποιηθούν μέταλλα, γραφίτης και ορισμένοι ημιαγωγοί. Είναι σημαντικό το υλικό να έχει επαρκή αγωγιμότητα. Ένα από τα πιο συνηθισμένα υλικά είναι ο χαλκός.
Χαρακτηριστικά της ηλεκτρόλυσης σε διαλύματα
Η ηλεκτρόλυση σε υδατικό διάλυμα είναι αρκετά διαφορετική από την ηλεκτρόλυση τήγματος. Εδώ υπάρχουν 3 ανταγωνιστικές διεργασίες: οξείδωση του νερού που εκλύει οξυγόνο, οξείδωση του ανιόντος και ανοδική διάλυση του μετάλλου. Η διαδικασία περιλαμβάνει ιόντα νερού, τον ηλεκτρολύτη και την άνοδο. Κατά συνέπεια, η αναγωγή του υδρογόνου, των κατιόντων του ηλεκτρολύτη και του μετάλλου ανόδου μπορεί να λάβει χώρα στην κάθοδο.

Η ικανότητα αυτών των ανταγωνιστικών διεργασιών να συμβούν εξαρτάται από το ηλεκτρικό δυναμικό του συστήματος. Μόνο η διαδικασία που απαιτεί λιγότερη εξωτερική ενέργεια θα πραγματοποιηθεί. Επομένως, τα κατιόντα με το υψηλότερο δυναμικό ηλεκτροδίου θα αναχθούν στην κάθοδο και τα ανιόντα με το χαμηλότερο δυναμικό θα οξειδωθούν στην άνοδο. Το δυναμικό ηλεκτροδίου του υδρογόνου λαμβάνεται ως "0". Για παράδειγμα, στο κάλιο ισούται με (-2,93 В), το νάτριο είναι (-2,71 В), μόλυβδος (-0,13 В), και για το ασήμι είναι (+0,8 В).
Ηλεκτρόλυση σε αέρια
Το αέριο μπορεί να λειτουργήσει ως ηλεκτρολύτης μόνο εάν υπάρχει ιονιστής. Στην περίπτωση αυτή, το ρεύμα ρέει μέσα από το ιονισμένο μέσο, προκαλώντας την απαραίτητη διεργασία στα ηλεκτρόδια. Οι νόμοι του Faraday δεν εφαρμόζονται στην ηλεκτρόλυση αερίου. Τέτοιες συνθήκες είναι απαραίτητες για την υλοποίησή του:
- Ούτε η υψηλή τάση ούτε το υψηλό ρεύμα μπορούν να βοηθήσουν χωρίς τεχνητό ιονισμό του αερίου.
- Μόνο αέρια οξέα χωρίς οξυγόνο και ορισμένα αέρια είναι κατάλληλα για ηλεκτρόλυση.
Σημαντικό! Η διαδικασία λειτουργεί με τρόπο παρόμοιο με την ηλεκτρόλυση σε υγρό ηλεκτρολύτη, εάν πληρούνται οι απαραίτητες προϋποθέσεις.
Χαρακτηριστικά των διεργασιών που λαμβάνουν χώρα στην κάθοδο και την άνοδο
Για την πρακτική εφαρμογή της ηλεκτρόλυσης, είναι σημαντικό να κατανοήσουμε τι συμβαίνει στα δύο ηλεκτρόδια όταν εφαρμόζεται ηλεκτρικό ρεύμα. Χαρακτηριστικές είναι οι ακόλουθες διεργασίες:
- Κάθοδος. Τα θετικά φορτισμένα ιόντα σπεύδουν προς αυτό. Εδώ λαμβάνει χώρα η αναγωγή των μετάλλων ή η απελευθέρωση υδρογόνου. Διάφορες κατηγορίες μετάλλων μπορούν να διακριθούν ανάλογα με την κατιονική τους δραστηριότητα. Μέταλλα όπως Li, K, Ba, St, Ca, Na, Mg, Be, Al ανάγονται καλά μόνο από λιωμένα άλατα. Εάν χρησιμοποιείται διάλυμα, το υδρογόνο απελευθερώνεται μέσω ηλεκτρόλυσης του νερού. Τα ακόλουθα μέταλλα μπορούν να ανακτηθούν σε διάλυμα, αλλά με επαρκή συγκέντρωση κατιόντων - Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Η διαδικασία είναι ευκολότερη για Ag, Cu, Bi, Pt, Au, Hg.
- Άνοδος. Τα αρνητικά φορτισμένα ιόντα τροφοδοτούνται σε αυτό το ηλεκτρόδιο. Καθώς οξειδώνονται, αφαιρούν ηλεκτρόνια από το μέταλλο, με αποτέλεσμα αυτό να διαλύεται ανοδικά, δηλ. Τα ανιόντα μετατρέπονται σε θετικά φορτισμένα ιόντα, τα οποία κατευθύνονται προς την κάθοδο. Τα ανιόντα υποδιαιρούνται επίσης ανάλογα με τη δραστηριότητά τους. Μόνο τα ανιόντα PO4, CO3, SO4, NO3, NO2, ClO4, F μπορούν να αποβληθούν από τα τήγματα. Σε υδατικά διαλύματα, δεν υπόκεινται σε ηλεκτρόλυση, αλλά σε νερό με την απελευθέρωση οξυγόνου. Τα πιο εύκολα αντιδρώντα ανιόντα είναι τα OH, Cl, I, S και Br.

Κατά την παροχή ηλεκτρόλυσης, είναι σημαντικό να λαμβάνεται υπόψη η τάση του υλικού του ηλεκτροδίου να οξειδώνεται. Γίνεται διάκριση μεταξύ αδρανών και ενεργών ανόδων. Τα αδρανή ηλεκτρόδια κατασκευάζονται από γραφίτη, άνθρακα ή πλατίνα και δεν συμμετέχουν στην παροχή ιόντων.
Παράγοντες που επηρεάζουν τη διαδικασία ηλεκτρόλυσης
Η διαδικασία ηλεκτρόλυσης εξαρτάται από τους ακόλουθους παράγοντες
- Η σύνθεση του ηλεκτρολύτη. Σημαντική επιρροή ασκούν οι διάφορες προσμίξεις. Αυτά χωρίζονται σε 3 τύπους - κατιόντα, ανιόντα και οργανικά. Οι ουσίες μπορεί να είναι περισσότερο ή λιγότερο αρνητικές από το βασικό μέταλλο, γεγονός που παρεμποδίζει τη διαδικασία. Μεταξύ των οργανικών προσμίξεων υπάρχουν ρύποι (π.χ. έλαια) και επιφανειοδραστικές ουσίες. Οι συγκεντρώσεις τους είναι στις μέγιστες επιτρεπτές τιμές.
- Πυκνότητα ρεύματος. Σύμφωνα με το νόμο του Faraday, η μάζα της εναποτιθέμενης ουσίας αυξάνεται με την ένταση του ρεύματος. Ωστόσο, προκύπτουν δυσμενείς συνθήκες - συγκεντρωμένη πόλωση, αυξημένη τάση, έντονη θέρμανση του ηλεκτρολύτη. Με αυτό κατά νου, υπάρχουν βέλτιστες τιμές για την πυκνότητα ρεύματος σε κάθε περίπτωση.
- pH ηλεκτρολύτη. Η οξύτητα του μέσου επιλέγεται επίσης με γνώμονα τα μέταλλα. Για παράδειγμα, το βέλτιστο pH για τον ψευδάργυρο είναι 140g/cc.
- Θερμοκρασία ηλεκτρολύτη. Αυτό έχει διφορούμενο αποτέλεσμα. Καθώς αυξάνεται η θερμοκρασία, ο ρυθμός ηλεκτρόλυσης αυξάνεται, αλλά το ίδιο συμβαίνει και με τη δραστικότητα των προσμίξεων. Υπάρχει μια βέλτιστη θερμοκρασία για κάθε διαδικασία. Συνήθως κυμαίνεται μεταξύ 38 και 45 μοιρών.
Σημαντικό! Η ηλεκτρόλυση μπορεί να επιταχυνθεί ή να επιβραδυνθεί από διάφορες επιδράσεις και την επιλογή της σύνθεσης του ηλεκτρολύτη. Για κάθε εφαρμογή υπάρχει ένα διαφορετικό καθεστώς το οποίο πρέπει να τηρείται αυστηρά.
Πού χρησιμοποιείται η ηλεκτρόλυση;
Η ηλεκτρόλυση χρησιμοποιείται σε πολλές εφαρμογές. Υπάρχουν διάφορες κύριες εφαρμογές που μπορούν να χρησιμοποιηθούν για την επίτευξη πρακτικών αποτελεσμάτων.
Ηλεκτρολυτική επιμετάλλωση
Μια λεπτή, σκληρή γαλβανική επίστρωση μετάλλου μπορεί να εφαρμοστεί με ηλεκτρόλυση. Το επικαλυμμένο αντικείμενο τοποθετείται σε ένα λουτρό ως κάθοδος και ο ηλεκτρολύτης περιέχει ένα άλας του επιθυμητού μετάλλου. Με αυτόν τον τρόπο μπορείτε να επικαλύψετε τον χάλυβα με ψευδάργυρο, χρώμιο ή κασσίτερο.

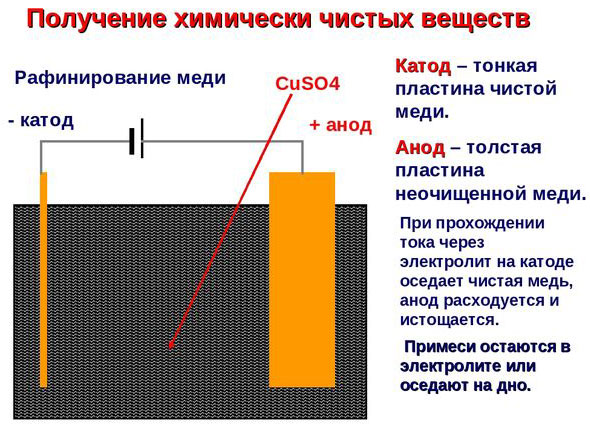
Ηλεκτροδιύλιση - διύλιση χαλκού
Ένα παράδειγμα διεργασίας ηλεκτροεπεξεργασίας θα ήταν κάθοδος - καθαρός χαλκός άνοδος - χαλκός με προσμίξεις, ηλεκτρολύτης - υδατικό διάλυμα θειικού χαλκού. Ο χαλκός από την άνοδο μετατρέπεται σε ιόντα και εναποτίθεται στην κάθοδο χωρίς προσμίξεις.
Εξόρυξη μετάλλων
Για την εξαγωγή μετάλλων από άλατα, τα μέταλλα λιώνουν και στη συνέχεια ηλεκτρολύονται στο τήγμα. Η διαδικασία αυτή είναι αρκετά αποτελεσματική για την ανάκτηση αλουμινίου από βωξίτη, νάτριο και κάλιο.

Ανοδίωση
Σε αυτή τη διαδικασία η επίστρωση κατασκευάζεται από μη μεταλλικές ενώσεις. Το κλασικό παράδειγμα είναι η ανοδίωση του αλουμινίου. Το τμήμα αλουμινίου τοποθετείται σαν άνοδος. Ο ηλεκτρολύτης είναι διάλυμα θειικού οξέος. Ως αποτέλεσμα της ηλεκτρόλυσης, ένα στρώμα οξειδίου του αλουμινίου εναποτίθεται στην άνοδο, το οποίο έχει προστατευτικές και διακοσμητικές ιδιότητες. Οι παραπάνω τεχνολογίες χρησιμοποιούνται ευρέως σε διάφορες βιομηχανίες. Είναι επίσης δυνατό να εκτελέσετε τις διαδικασίες με τα χέρια σας και με ασφαλή τρόπο.
Ενεργειακό κόστος
Η ηλεκτρόλυση απαιτεί μεγάλη ποσότητα ενέργειας. Η διαδικασία θα έχει πρακτική αξία εάν το ανοδικό ρεύμα είναι επαρκές, πράγμα που απαιτεί την εφαρμογή σημαντικού συνεχούς ρεύματος από την πηγή ενέργειας. Επιπλέον, παράγει απώλειες πλευρικής τάσης - ανοδικές και καθοδικές υπερτάσεις και απώλειες στον ηλεκτρολύτη λόγω της αντίστασής του. Ο βαθμός απόδοσης μιας μονάδας προσδιορίζεται με τη σχέση της ισχύος της εισερχόμενης ενέργειας προς τη μονάδα ωφέλιμης μάζας της παραγόμενης ουσίας.
Η ηλεκτρόλυση χρησιμοποιείται από καιρό στη βιομηχανία με υψηλή απόδοση. Η ανοδίωση και η ηλεκτρολυτική επιμετάλλωση έχουν γίνει κοινός τόπος στην καθημερινή ζωή, ενώ η εξόρυξη και η επεξεργασία υλικών συμβάλλει στην εξαγωγή πολλών μετάλλων από το μετάλλευμα. Η διαδικασία μπορεί να προγραμματιστεί και να υπολογιστεί γνωρίζοντας τα βασικά μοτίβα της.
Σχετικά άρθρα: